
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
Химическое превращение – качественный скачек, при котором исчезают одни вещества и образуются другие. При этом происходит перестройка электронных структур атомов и молекул, которая сопровождается выделением или поглощением теплоты, света, электричества (превращение химической энергии в другой вид энергии).
Реакции, протекающие с выделением энергии, чаще всего в виде тепла, называют экзотермическими, а реакции, при которых энергия поглощается – эндотермическими.
Энергетический эффект химического процесса возникает за счет изменения в системе внутренней энергии U или энтальпии H.
Внутренняя энергия – форма энергии, скрытая в веществах и освобождающаяся при химических процессах. Она складывается из энергии движения и взаимодействия молекул, энергии движения и взаимодействия ядер и электронов в атомах и молекулах, внутриядерной энергии.
Внутренняя энергия является функцией состояния вещества. Пусть в результате какого-либо процесса система переходит из состояния 1 (U1) в состояние 2 (U2), при этом из внешней среды поглощается теплота Q, и система совершает работу A против внешних сил:
U2 = U1 + Q – A или ΔU = Q – A (1)
Для химических реакций под работой против внешних сил в основном подразумевается работа против внешнего давления A = p(V2 – V1) = pΔV. Уравнение (1) выражает закон сохранения энергии, изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состояниями системы.
Если при реакции не происходит изменения объема ΔV = 0 (изохорный процесс), то A = 0; ΔU = Q. В случае изохорной химической реакции изменение внутренней энергии системы равно, но противоположно по знаку тепловому эффекту этой реакции.
В химии чаще всего имеют дело с изобарными процессами, то есть процессами, происходящими при постоянном давлении. Здесь удобно пользоваться величиной энтальпии H = U + pV.
A = pΔV → ΔH = ΔU + pΔV или ΔU = ΔH – pΔV
ΔU = Q – A Q – A = ΔH – pΔV → ΔH = Qp
Итак, изменение энтальпии равно, но противоположно по знаку тепловому эффекту реакции, проведенной при постоянном давлении и постоянной температуре.
При экзотермических реакциях теплота выделяется, величины U и H уменьшаются, а ΔU и ΔH – отрицательны.
При эндотермических реакциях теплота поглощается, U и H увеличиваются, а ΔU и ΔH – положительны.
Для того, чтобы можно было сравнивать энергетические эффекты различных процессов, термохимические расчеты обычно относят к 1 молю вещества и стандартным условиям: Р = 1 атм (101325 Па) и Т = 25oС (298,15 К).
Термодинамический анализ химико-технологических процессов
Позволяет сделать вывод о направлении протекания процесса (вправо или влево), предварительно выбрать условия проведения процесса, определить равновесный состав продуктов реакции, а также рассчитать тепловые эффекты.
Величины, характеризующие состояние термодинамических систем, называются термодинамическими параметрами. К ним относятся: температура, давление, удельный объем, плотность, удельная внутренняя энергия и др.
Термодинамические параметры делятся на экстенсивные и интенсивные. Параметры, которые пропорциональны массе системы, называются экстенсивными: это объем, внутренняя энергия, энтальпия, энтропия. Экстенсивные параметры обладают свойством аддитивности (их можно складывать).
Интенсивные параметры не зависят от массы термодинамической системы: это температура, давление, а также экстенсивные величины, отнесенные к единице массы или объема системы (удельная теплоемкость, плотность и др.).
Изменение интенсивных параметров с целью ускорения химико-технологических процессов называется интенсификцией.
14. Равновесие химических pеакций. Пpинцип Ле-Шателье. Константа равновесия на пpимеpе pеакции aA+bB=dD. Зависимость константы pавновесия от темпеpатуpы.
Химическим равновесием называется такое состояние обратимой химической реакции aA + bB = cC + dD, при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
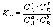 ,
(1.1)
,
(1.1)
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
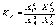 .
(1.2)
.
(1.2)
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
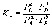 .
(1.3)
.
(1.3)
Для идеальных газов Pi = CiRT и Pi = XiP, где P – общее давление, поэтому KP, KC и KX связаны следующим соотношением:
KP = KC (RT) c+d–a–b = KXP c+d–a–b. (1.4)
Константа
равновесия связана с 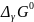 химической реакции:
химической реакции:
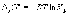 (1.5)
(1.5)
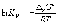 (1.6)
(1.6)
Изменение 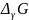 или
или 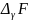 в
химической реакции при заданных (не
обязательно равновесных) парциальных
давлениях Pi или
концентрациях Ci компонентов
можно рассчитать по уравнению изотермы
химической реакции (изотермы
Вант-Гоффа):
в
химической реакции при заданных (не
обязательно равновесных) парциальных
давлениях Pi или
концентрациях Ci компонентов
можно рассчитать по уравнению изотермы
химической реакции (изотермы
Вант-Гоффа):
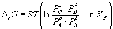 .
(1.7)
.
(1.7)
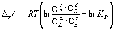 .
(1.8)
.
(1.8)
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
 (1.9)
(1.9)
и изохоры химической реакции (изохоры Вант-Гоффа)
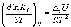 .
(1.10)
.
(1.10)
Интегрирование
уравнения (1.9) в предположении, что 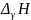 реакции
не зависит от температуры (что справедливо
в узких интервалах температур), дает:
реакции
не зависит от температуры (что справедливо
в узких интервалах температур), дает:
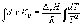 (1.11)
(1.11)
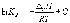 (1.12)
(1.12)
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – /R.
Интегрирование в пределах K1, K2, и T1, T2 дает:
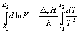 (1.13)
(1.13)
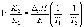 (1.14)
(1.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать реакции. Соответственно, зная реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
