
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
56. Получение азотной кислоты. Основные стадии пpоизводства.
Азотная кислота – важнейший продукт химической промышленности. Ее применяют для получения азотных удобрений, технических нитратов, взрывчатых веществ, красителей. Промышленность выпускает разбавленную и концентрированную азотную кислоту. Товарным продуктом являются меланж (смесь азотной и серной кислоты) и концентрированная азотная кислота. Разбавленная азотная кислота имеет концентрацию 55-60%. В н.в. азотная кислота производится из аммиака.
|
Кратко процесс получения получения азотной кислоты из аммиака состоит из следующих этапов:
1) Подготовка аммиачно-воздушной смеси: очистка поступающего аммиака от примесей, которые являются ядами для катализаторов.
2) Окисление аммиака кислородом воздуха на платиновой сетке:
![]()
3) Дальнейшее окисление оксида азота (II) до оксида азота (IV):
![]()
4) Растворение оксида азота (IV) в воде и получение кислоты:
![]()
Если растворение проводить в присутствии кислорода, то весь оксид азота (IV) переходит в азотную кислоту.
57. Окисление аммиака. Физико-химические основы пpоцесса.
Каталитическое окисление аммиака является очень сложным процессом и может с одинаковой степенью вероятности протекать как до целевого продукта оксида азота II, так и до молекулярного азота и оксида азота I. В общем виде протекающие реакции описываются уравнениями:
4NH3 + 5O2 = 4NO + 6H2O ΔrH0(298) = – 904,0 кДж/моль (5.1)
4NH3 + 4O2 = 2N2O + 6H2O ΔrH0(298) = – 1104,4 кДж/моль (5.2)
4NH3 + 3O2 = 2N2 + 6H2O ΔrH0(298) = – 1268,8 кДж/моль (5.3)
Кроме основных реакций (5.1) – (5.3), в зависимости от условий окисления аммиака могут протекать несколько последовательных и параллельно – последовательных реакций. Все они приводят к образованию молекулярного азота. Так, образовавшийся по реакции оксид азота II может разлагаться по реакции
2NO = N2 + O2 ΔrH0(298) = – 180,6 кДж/моль (5.4)
или взаимодействовать с аммиаком:
4NH3 +6NO = 5N2 + 6H2O ΔrH0(298) = – 1810,5 кДж/моль (5.5)
Аммиак, поступающий с аммиачно-воздушной смесью (АВС), может разлагаться до молекулярного азота и водорода, причем последний затем сгорает с образованием паров воды:
2NH3 = N2 + 3H2 ΔrH0(298) = +91,6 кДж/моль (5.6)
Таким образом, при окислении аммиака состав конечных продуктов определяется в первую очередь селективным каталитическим действием катализаторов.
Для процесса каталитического окисления аммиака активность катализатора характеризует общее превращение аммиака в оксиды азота и элементарный азот, а селективность – выход полезного продукта – оксида азота II.
58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
В отсутствие катализатора наиболее быстро протекает реакция (3.3) –окисление аммиака до свободного азота.
Для ускорения реакции (3.1) – окисление аммиака до NO – необходим катализатор. Поскольку при окислении аммиака протекают три реакции (3.1; 3.2; 3.3), а целевой является реакция (3.1), то важнейшим условием является выбор катализатора, отличающегося высокой селективностью.
Катализаторы, избирательно ускоряющие реакцию (3.1) можно разделить на два вида:
– платина и её сплавы с металлами платиновой группы (родием и палладием).
– оксиды железа, никеля и кобальта.
В азотнокислотной промышленности применяют в основном платиновые катализаторы. Окисление аммиака на платиновом катализаторе относится к числу наиболее быстрых каталитических реакций. В производственных условиях практически полное окисление аммиака в NO достигается за время (1–2)·10–4 секунды (0,0001 – 0,0002 с).
Время контактирования. Можно и нужно ли изменять время пребывания реагентов на контактной массе? Время изменять нецелесообразно, так как при уменьшении длительности контакта часть аммиака «проскакивает», не успевая окислиться, а при увеличении времени контактирования реакционная смесь перегревается, возрастает вклад реакции (3.3) с образованием свободного азота.
В промышленности для окисления аммиака применяют из первой группы платиновые катализаторы. Это сплав платины Pt с палладием Pd (4 %) и родием Rh (3%). (Введение до 7,5% родия Rh повышает механическую прочность катализатора и вследствие этого уменьшаются потери платины за счёт уноса газом).
Платиновые катализаторы выполняются в виде сеток из тонкой проволоки диаметром 0,06 – 0,09 мм, имеющих 1024 отверстий в 1см2. Сетки скрепляются в виде пакета, устанавливаемого в контактном аппарате.
На 1м2 активной поверхности контактной сетки под атмосферным давлением (0,1 МПа) можно окислить до 600 кг аммиака, а при давлении 0,8 МПа – до 3000 кг аммиака в сутки.
Однако при работе под давлением 0,8 МПа и более платиновый катализатор разрушается быстрее.
Разрушению катализатора способствуют также многие контактные яды (соединения серы, фосфин и другие), которые помимо отравления катализатора снижают его механическую прочность. Примеси (пыль, ржавчина, смазочные масла), содержащиеся в газе, также снижают активность и прочность катализатора.
Для восстановления катализатора его промывают разбавленным раствором соляной кислоты.
Всё перечисленное приводит к тому, что в процессе окисления аммиака катализатор становится рыхлым, и мельчайшие частицы его уносятся с потоком газа. Если под атмосферным давлением унос платины на 1т азотной кислоты составляет 0,04 – 0,06 г, то при повышенном он достигает уже 0,15 – 0,20 г на 1т.
Часть платины улавливается и регенерируется, НО и при этом расход платины составляет значительную часть себестоимости азотной кислоты.
С целью экономии платины в промышленности применяют двухстадийное контактирование, при котором аммиак частично окисляется на платиноидных сетках, а затем доокисляется в слое неплатинового зернистого катализатора.
В качестве неплатиновых катализаторов применяют различные композиции оксидов или солей, в том числе оксиды железа или хрома, соли хрома.
Удельная производительность платинового катализатора велика благодаря высокой скорости реакции окисления аммиака. Для платинового катализатора скорость всего процесса окисления определяется диффузионными процессами.
В промышленности применяют разные типы контактных аппаратов для окисления аммиака, но все они имеют одинаковый принцип действия.
При повышенном давлении устанавливают до 18 сеток. Но если применять двухстадийное контактирование число платиноидных сеток может быть уменьшено до 1 – 3.
Механизм действия катализатора.
Механизм гетерогенного окисления аммиака состоит из следующих последовательных стадий:
– диффузия молекул NH3 и O2 из газовой фазы к поверхности катализатора;
– активированная адсорбция молекул O2 на поверхности катализатора с образованием промежуточного соединения;
– хемосорбция молекул NH3 с образованием комплекса;
– разложение комплекса с регенерацией катализатора и образованием молекул NO и H2O (или десорбция продуктов реакции);
– диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей или лимитирующей стадией всего процесса окисления является диффузия O2 к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузной области.
Окисление аммиака на оксидном железном катализаторе идет кинетической области.
Селективность процесса окисления NH3 до NO в присутствии платиновых катализаторов выражается уравнением:
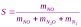
и составляет 0,95 – 0,98 долей единицы.
