
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
51. Синтез аммиака. Физико-химические основы пpоцесса.
Синтез аммиака осуществляется из азота и водорода по реакции:
N2 + 3Н2 ⇔ 2 NН3 + Q,
Реакция обратимая, экзотермическая и характеризуется большим тепловым эффектном.
Согласно принципу Ле-Шателье равновесие ее смещается вправо с повышением давления и понижением температуры. Зависимость константы равновесия КР от температуры и давления имеется в справочной литературе.
Однако без использования катализаторов скорость реакции даже при температуре равной 1000 °С практически равна нулю. Это объясняется очень высокой энергией активации этой реакции.
Поэтому процесс проводят в присутствии твердых катализаторов. Как известно, гетерогенно-каталитические реакции имеют несколько стадий, в том числе:
А) диффузия молекул азота и водорода к поверхности зерен катализатора;
Б) хемосорбция этих молекул на поверхности катализатора;
В) поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействие между ними;
Г) десорбция продукта - аммиака с поверхности катализатора;
Д) диффузия молекул аммиака от поверхности катализатора в газовую фазу.
Исследования показали, что наиболее медленной (лимитирующей) этого сложного процесса является стадия хемосорбции молекул азота, так как он имеет наибольшую молекулярную массу.
На основании этого вывода можно описать механизм синтеза аммиака упрощенной схемой:
N2 + К ⇔ N2.К;
N2.К + 3Н2 ⇔ 2NН3 + К;
где К - свободный активный центр поверхности катализатора;
N2.К - хемосорбированный активный комплекс на поверхности катализатора.
Скорость обратимой реакции синтеза аммиака из водорода и азота на большинстве известных катализаторов можно описать уравнением Темкина- Пыжова:
W = k1.PN2(P3Н2/ Р2NН3)а - k2(Р2NН3/Р3Н2)1-а,
где k1 и k2 - константы скоростей образования и разложения аммиака;
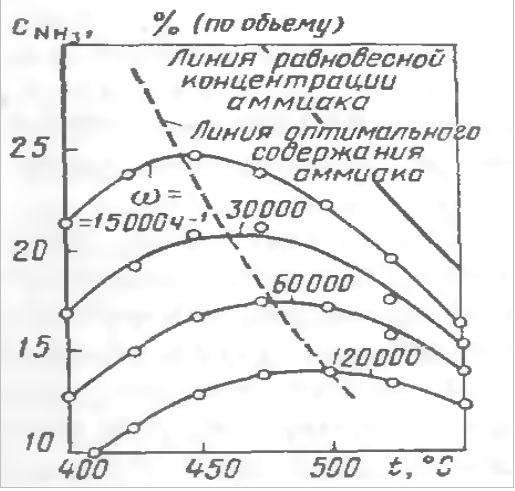
(Рис. а). Зависимость содержания аммиака в АВС от температуры при различных объемных скоростях АВС.
Давление 30 МПа
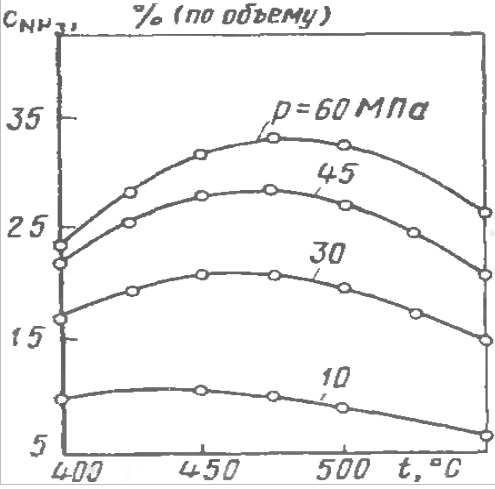
(Рис. б). Зависимость содержания аммиака в АВС от температуры при различных давлениях.
Объемная скорость АВС 30000 час-1
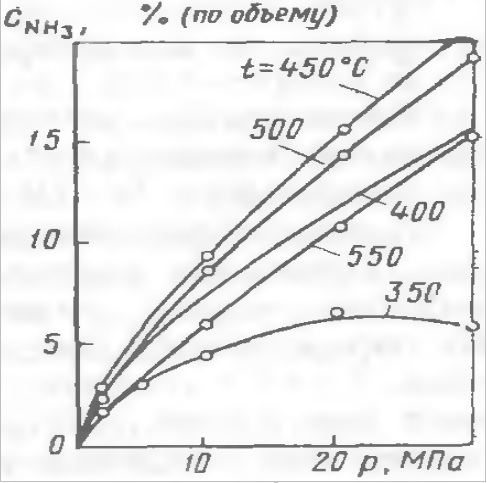
(Рис. в). Зависимость содержания аммиака в АВС от давления при различных температурах.
Объемная скорость АВС 30000 час-1
Так как реакция синтеза аммиака обратима, то возможная степень превращения исходного сырья на железных катализаторах не превышает 20-40%. Поэтому все современные схемы производства являются циркуляционными, то есть подается в колонну синтеза многократно с постоянным выделением образовавшегося аммиака путем его конденсации при низких температурах. Достичь полной конденсации также не удается Зависимость остаточной концентрации аммиака в газовой фазе после его конденсации при давлении 30 МПа следующая:
Температура, град. С |
- 20 |
- 10 |
0 |
+5 |
+10 |
+15 |
+20 |
+25 |
Остаточная концентрация аммиака в газовой фазе, % об. |
1,5 |
2,15 |
3,2 |
4,0 |
4,75 |
5,5 |
6,2 |
7,3 |
