
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
Со второй половины 60-х годов в СССР проведены интенсивные исследования ванадиевых катализаторов. Изучены диаграммы состояния систем: V2O5-K2S2O7 и VOSO4, влияние толщины слоя активного компонента на степень его использования, исследованы механизм и кинетика окисления диоксида серы.
Представление о механизме реакции базируется на результатах исследования кинетики реакции стационарного состава активного компонента.
Схема процесса может быть сформулирована следующим образом:
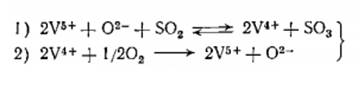
В первой стадии достигается равновесие, а вторая стадия является медленной и определяет скорость процесса.
Предлагаемая схема является окислительно-восстановительной и соотношение между двумя ступенями окисления ванадия в условиях стационарного состояния катализатора определяет его активность.
Стационарный состав катализатора не зависит от концентрации кислорода в газовой фазе и определяется только соотношением концентраций S0 2 и S03. Установлено, что при обработке катализатора инертным газом в отсутствии кислорода наблюдается окисление четырехвалентной формы ванадия, содержание которой возрастает после подачи реакционной смеси до равновесного состояния. При справедливости рассмотренного механизма (А), скорость каталитической реакции должна равняться скорости окисления катализатора кислородом и быть меньше скорости восстановления. В действительности, в область температур выше 420 °С скорость каталитической реакции много больше скорости восстановления катализатора. В связи с этим вероятен механизм, в котором процесс протекает по пути, не связанном с изменением валентного состояния ванадия.
Схему такого процесса можно представить в следующем виде:
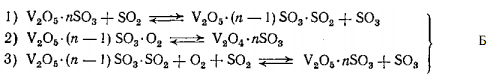
В этом случае скорость каталитической реакции должна быть пропорциональна доле активного компонента в окисленной форме и по этому механизму каталитическая реакция протекает в присутствии триоксида серы в газовой фазе.
Скорости окисления четырехвалентного ванадия кислородом и каталитической реакции в отсутствии триоксида серы близки и при малых степенях превращения процесс протекает по окислительно-восстановительному механизму, который может быть представлен схемой:
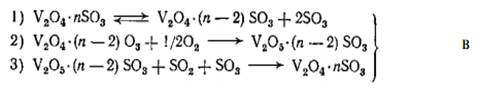
Стадия 1 в условиях протекания каталитической реакции находится в равновесии. Стадия 2 является сложной и определяет скорость протекания реакции. Порядок этой реакции по кислороду равен 1. Стадия 3 проходит с большой скоростью, что практически приводит к полному восстановлению ванадия.
Таким образом, кинетические закономерности достаточно сложны. Исследованию кинетики окисления диоксида серы на ванадиевых катализаторах посвящено большое число работ, в которых предложены различные уравнения для расчета массы катализатора, загружаемого в контактные аппараты.
В СССР применяют уравнение Института катализа:
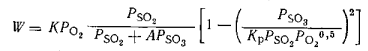
(1)
Постоянная А изменяется в пределах 0,8-1,0 в зависимости от типа катализатора и температуры.
Область условий протекания реакции в промышленных аппаратах: концентрация диоксида серы 4-12%, кислорода 6-13%. При двойном контактировании их содержание на второй стадии снижается примерно до 1 и 4% соответственно. Температурный интервал 400-600 °С. Обычно процесс ведут до степени превращения диоксида серы 98,0% при одинарном и 99,8% при двойном контактировании.
Подробное изучение зависимости скорости реакции от концентрации S02, S03 и 02 показало, что в области температур выше 470 °С во всем интервале степеней превращения наблюдается первый порядок реакции по кислороду. Скорость реакции является функцией отношения PSO3 : PSO2 . С повышением, концентрации кислорода может наблюдаться порядок реакции ниже первого.
Понижение температуры существенно усложняет зависимость скорости реакции от концентрации. В области низких температур и степеней превращения скорость реакции пропорциональна концентрации кислорода, не зависит от концентрации S02 и сильно тормозится S03.
Работа всех слоев катализатора в промышленных аппаратах описывается кинетическим уравнением (1), кроме начала первого слоя, где применимо уравнение, предлагаемое Институтом катализа, описывающее процесс при допущении, что весь ванадий находится в четырехвалентном состоянии:
![]()
(2)
Применение кинетических уравнений к расчету необходимого времени соприкосновения для достижения заданной степени конверсии проводится при учете работы катализатора в контактном аппарате в адиабатических условиях, т. е. без отвода выделяемой теплоты реакции. Это приводит к непрерывному нагреванию слоя по мере продвижения газа. Степень нагрева пропорциональна степени превращения и концентрации диоксида серы в газе.
