- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
Реакторы вытеснения – трубчатые аппараты, достаточно большой длины по сравнению с диаметром. В таких аппаратах течение реакционного потока имеет поршнеобразный характер. Перемешивание в таких реакторах имеет локальный характер и вызывается неравномерностью распределения скорости потока и его флуктуациями, а также завихрениями.
Реакторы смешения – это емкостные аппараты с перемешиванием механической мешалкой или циркуляционным насосом. Иногда в качестве способа перемешивания используется барботаж газообразного реагента через слой жидкой реакционной массы.
Р ис.
Модель потока идеального вытеснения
ис.
Модель потока идеального вытеснения
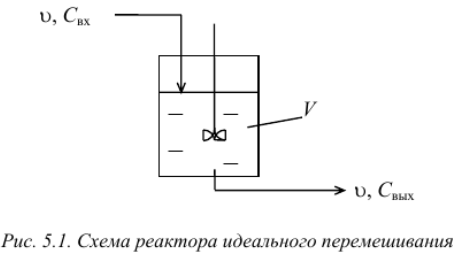
30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
При одинаковых условиях проведения одной и той же реакции для достижения равной глубины превращения среднее время пребывания реагентов в проточном реакторе идеального смешения больше, чем в реакторе идеального вытеснения. Скорость реакции, согласно закону действующих масс, пропорциональна концентрации реагентов. Следовательно, в реакторе идеального вытеснения она всегда выше, чем в проточном реакторе идеального смешения.
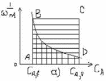
Ранее указывалось, что для проточного реактора идеального смешения (а) среднее время пребывания (τ): τС=(CA,0-CA,f)*(1/wrA*(CA,f)) или τС=(xA,f)*(CA,0/wrA*(xA,f)), то есть определяется произведением двух постоянных величин и геометрически может быть представлено виде прямоугольника с соответствующими сторонами:
|
|
Для стационарного реактора идеального вытеснения (б): CA,f τ B= - ∫1/(wr,A(CA))*dCA, или CA,0 XA,f τ B= CA,0 ∫ 1/(wr,A(xA)) *dxA 0 |
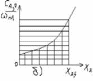
То есть величина τB, как определённый интеграл выражается площадью криволинейной трапеции.
Из рисунка видно, что площади криволинейных трапеций, соответствующие τB меньше площадей прямоугольников, соответствующих τС, причём разница тем больше, чем больше достигаемая в реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе и одинаковом выходе продукта, реактор идеального вытеснения должен иметь меньший объём, чем проточный реактор идеального смешения. Интенсивность J=П/V будет выше.
Достигаемая на выходе из реактора концентрация целевого продукта СR будет определяться, с одной стороны, выбранным типом реактора, а с другой – кинетическими особенностями реакций, которые могут быть учтены через дифференциальную селективность φ’, равную отношению скорости расходования реагента А на целевую реакцию к общей скорости его расходования.
Сравним проточные реакторы идеального вытеснения и идеального смешения при проведении параллельных реакций разного порядка: a1A→rR и a2A→sS (1) по выходу целевого продукта (R). Выход (R) может быть представлен: ФR=CR/CR,MAX=CR/(CA,0 *r/a1) (2). Уравнение (1) представим: A→r/a1 * R; A→S/a2 * S (3). Скорость расходования продукта А (на целевую реакцию): ωA=1/(r/a) * dCR/dτ. Тогда φ’=[(1/(r/a))*dCR/dτ]/-dCA/dτ=-1/(r/a1) * dCR/dCA (4) Проинтегрировав уравнение (4), получим зависимость CR от дифференциальной селективности φ’:
CA,f CA,f
CR=-r/a1 ∫ φ’dCA (5) , подставим (5) в (2), получим ФR=-1/CA,0 ∫ φ’ dCA (6)
CA,0 CA,0
Здесь дифференциальная селективность, стоящая, под знаком интеграла является в общем случае убывающей или возрастающей функцией от концентрации исходного реагента А (см. 4). Если φ’ не постоянна, необходимо провести интегрирование для определения ФR (см. 6). В частности, для реактора идеального вытеснения (РИВ). Если CA постоянна по всему объёму и во времени, то уравнение (6) для (РИС) реактора идеального смешения можно упростить: ФR,C=(CA,0-CA,f)/CA,0 * φ’(CA,f) (7). Выход целевого продукта по уравнениям (6) и (7) для РИВ и РИС можно представить графически в виде площадей криволинейной трапеции (ФR,B) (1) и прямоугольника (ФR,C). На рисунках n1 и n2 – обозначены порядки соответственно целевой и побочной реакций.
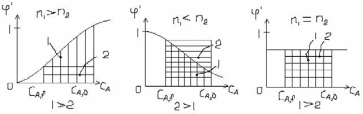
Если n1 > n2, то выход целевого продукта в РИВ больше, чем в РИС, если n1< n2, то выход целевого продукта в РИС больше, чем в РИВ, при n1 = n2 выход целевого продукта в РИС одинаков с таковым в РИВ. Это надо учитывать при выборе типа реактора, также надо учитывать, что РИВ имеет меньший объём, но большее сопротивление и трудность чистки таких аппаратов. РИС имеют низкие концентрации, низкие скорости реакции: чтобы использовать преимущества РИС и увеличение концентрации, можно использовать каскад РИС при их последовательном включении.