
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
Существует
несколько приемов установления
лимитирующей стадии. Рассмотрим только
один – зависимость скорости процессов
от температуры м u=¦(t) ![]()
Согласно
закона Вант-Гоффа V1 =
V2 ∙γ ![]() при
увеличении температуры на каждые 10°С
скорость химической реакции возрастает
в некоторых случаях в 2-4 раза, зависимость
скорости диффузии газов от температуры
в значительно меньшей степени.
при
увеличении температуры на каждые 10°С
скорость химической реакции возрастает
в некоторых случаях в 2-4 раза, зависимость
скорости диффузии газов от температуры
в значительно меньшей степени.
D=a×T2 .
a – постоянный коэффициент
T – абсолютная температура
D – коэффициент диффузии.
 Из
уравнения следует, что при возрастании
температуры на 10°С скорость диффузии
увеличивается на 3-5%. Это разное влияние
температуры используют для определения
лимитирующей стадии процесса.
Из
уравнения следует, что при возрастании
температуры на 10°С скорость диффузии
увеличивается на 3-5%. Это разное влияние
температуры используют для определения
лимитирующей стадии процесса.
Гетерогенные процессы протекают обычно при участии следующих стадий:
1. Транспорт реагентов к границе раздела фаз.
2. Сорбция реагентов на границе раздела фаз.
3. Химическая реакция на поверхности раздела фаз.
4. Десорбция продуктов реакции с границы раздела фаз.
5. Транспорт продуктов реакции в глубину сплошной фазы
25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
Внешняя диффузия – подвод реагента к поверхности твердой частицы через слой газа, обедненный этим компонентом.
Внутренняя диффузия – проникновение газообразного реагента через поры твердого продукта реакции к ядру твердого реагента.
26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
Область
гетерогенного процесса можно определить
по зависимости эффективной скорости
процесса ![]() от
условий протекания процесса.
от
условий протекания процесса.
По зависимости наблюдаемой скорости процесс от относительной скорости движении фаз.
Если
наблюдаемая скорость процесс зависит
от скорости движения фаз, то общая
скорость процесса контролируется
скоростью массопереноса. Это означает,
что ![]() и
процесс происходит в диффузионной
области, так как скорость массопередачи
увеличивается при увеличении скорости
обтекания твердой фазы, за счет уменьшения
толщины диффузионного пограничного
слоя, в соответствии с уравнениями,
вытекающими из 1-гозакона Фика. Лимитирующей
стадией процесса при протекании процесса
в диффузионной области является скорость
диффузии через неподвижный диффузионный
слой на поверхности раздела фаз:
и
процесс происходит в диффузионной
области, так как скорость массопередачи
увеличивается при увеличении скорости
обтекания твердой фазы, за счет уменьшения
толщины диффузионного пограничного
слоя, в соответствии с уравнениями,
вытекающими из 1-гозакона Фика. Лимитирующей
стадией процесса при протекании процесса
в диффузионной области является скорость
диффузии через неподвижный диффузионный
слой на поверхности раздела фаз:
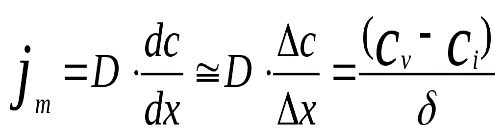 (4.4.8)
(4.4.8)
Где ![]() -
толщины диффузионного пограничного
слоя, которая зависит от скорости
обтекания.
-
толщины диффузионного пограничного
слоя, которая зависит от скорости
обтекания.
Например, на рис. Показано влияние скорости перемешиваниия на скорость растворения цинка в кислоте
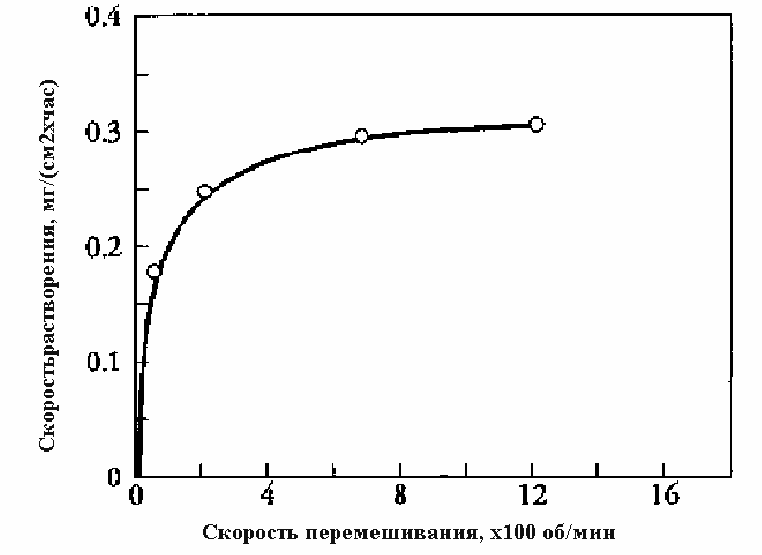
Рис.4.4.1. Зависимость скорости растворения цинка от скорости вращения мешалки.
Из рисунка видно, что при увеличении скорости вращения мешалки до 800 об/мин дальнейшее увеличение скорости растворения практически прекращается. Причиной этого может быть переход процесса в кинетическую область, где скорость процесс не зависит от скорости транспорта реагента к поверхности раздела фаз, на которой происходит химическое превращение.
Другим способом определения области протекания гетерогенного процесса является исследование зависимости общей скорости процесса от температуры.
Известно, что энергия активации химических процессов находится обычно в интервале 40200 кДж/моль. В то время как энергия активации диффузионных процессов, протекающих в жидких или газообразных средах находится в пределах 420 кДж/моль
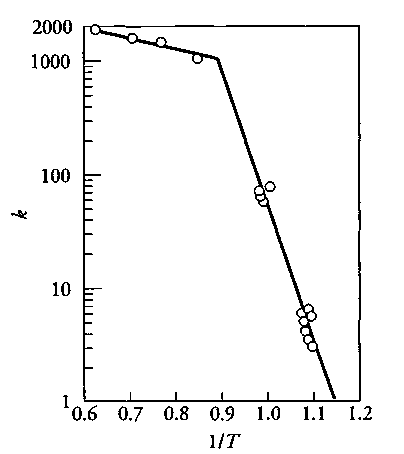
Рис.4.4.2: Влияние температуры на реакцию C+½O2→CO. В интервале температур 600-800°C, E=174 кДж/моль (химический контроль), и в интервале 1100-1300°C, E=6.3 кДж/моль (диффузионный контроль)
На рис.4.4.2 показано влияние температуры на реакцию окисления углерода при недостатке кислорода. Из рисунка видно, что в интервале температур 600-800°C, поверхностная реакция окисления является боле медленной стадией, чем скорость транспорта кислорода к реакционной поверхности. При достижении температуры 1000С скорость поверхностной реакции увеличивается настолько, что скорость транспорта кислорода к реакционной поверхности становится медленнее возможной скорости его расхода и гетерогенный процесс окисления переходит в область диффузионного контроля.
