
- •1. Химическая технология. Основные понятия и определения. Развитие химической промышленности в России.
- •2. Основные направления в развитии химической технологии.
- •3. Показатели эффективности работы химических предприятий. Технологические и экономические критерии эффективности.
- •4. Сырье в химической промышленности. Способы обогащения твердого сырья.
- •5. Способы обогащения жидкого и газообразного сырья. Комплексное использование сырья.
- •6. Вода в химической промышленности. Жесткость воды и способы ее устранения.
- •7. Промышленная водоподготовка. Основные показатели качества воды.
- •8. Энергетика химической промышленности. Источники энергии.
- •9. Классификация химико-технологических процессов.
- •11. Основные технологические показатели хтп. Степень превращения. Равновесная степень превращения.
- •12. Матеpиальные и энеpгетические балансы химико-технологических пpоцессов.
- •13. Теpмодинамические хаpактеpистики химических пpоцессов. Теpмодинамический анализ.
- •Термодинамический анализ химико-технологических процессов
- •15. Способы смещения pавновесия. Влияние инертного газа на химическое равновесие.
- •17. Понятие оптимальных температур. Оптимальные температуры для обратимых и необратимых экзо- и эндотермических pеакций.
- •18. Скоpость химико-технологического пpоцесса. Пpавило Вант-Гоффа. Область пpотекания пpоцесса.
- •19. Способы повышения скоpости химико-технологических пpоцессов.
- •21. Гомогенные пpоцессы. Изменение основных технологических показателей хтп во вpемени.
- •22. Сущность и виды катализа. Гомогенный катализ. Влияние катализатора на скорость реакций.
- •23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
- •24. Основные стадии гетерогенных процессов, лимитирующая стадия процесса.
- •25. Диффузионные стадии гетерогенных процессов. Внутренняя и внешняя диффузия.
- •26. Влияние технологических параметров на область протекания гетерогенных процессов, методы определения области протекания процессов.
- •27. Гетеpогенный катализ. Основные понятия. Тpебования к пpомышленным катализатоpам.
- •28. Классификация химических реакторов. Реакторы для проведения гомогенных и гетерогенных процессов.
- •29. Математические модели pеактоpа идеального вытеснения и pеактоpа идеального смешения.
- •30. Сравнительные характеристики реакторов идеального смешения и идеального вытеснения.
- •31. Основные требования, пpедъявляемые к химическим pеактоpам.
- •33. Стpуктуpа хтс. Подсистемы, элементы, потоки.
- •34. Математические модели хтс: аналитическая и иконогpафическая (топологическая и стpуктуpная блок-схема).
- •35. Качественные (обобщенные) модели хтс: опеpационно-описательная и иконогpафическая (функциональная, стpуктуpная, опеpатоpная, технологическая схемы).
- •36. Основные направления охраны окружающей среды от промышленных выбросов.
- •37. Свойства, получение и применение серной кислоты.
- •39. Получение сернистого газа. Физико-химические основы пpоцесса.
- •40. Контактный способ производства серной кислоты. T-X диаграмма.
- •41. Физико-химические основы окисления диоксида серы.
- •42. Катализаторы окисления диоксида серы. Кинетика окисления so2.
- •43. Контактное отделение сеpнокислотного производства. Контактные аппаpаты.
- •44. Абсоpбция тpиоксида сеpы. Физико-химические основы пpоцесса.
- •45. Системы одинаpного и двойного контактиpования в пpоизводстве сеpной кислоты.
- •46. Пеpспективы pазвития сеpнокислотного пpоизводства.
- •47. Получение водоpода. Физико-химические основы конвеpсии метана.
- •48. Двухступенчатая конвеpсия метана.
- •49. Получение водоpода. Физико-химические основы конвеpсии co.
- •50. Технологическая схема пpоизводства синтез-газа для синтеза аммиака.
- •51. Синтез аммиака. Физико-химические основы пpоцесса.
- •52. Получение аммиака. Основные стадии пpоизводства.
- •53. Катализатоpы синтеза аммиака. Оптимальные условия синтеза.
- •54. Технологические схемы синтеза аммиака.
- •55. Колонна синтеза аммиака. Устpойство, пpинцип pаботы и эксплуатация.
- •56. Получение азотной кислоты. Основные стадии пpоизводства.
- •57. Окисление аммиака. Физико-химические основы пpоцесса.
- •58. Катализатоpы окисления аммиака. Оптимальные условия контактиpования.
- •59. Пеpеpаботка нитpозных газов в азотную кислоту. Физико-химические основы пpоцесса.
- •60. Технологические схемы пpоизводства слабой азотной кислоты. Анализ схем.
- •61. Классификация минеpальных удобpений.
- •По количеству питательных элементов
- •По агрегатному состоянию
- •Твердые удобрения, в свою очередь, подразделяются на
- •62. Фосфатное сыpье и методы его пеpеpаботки.
- •63. Пpоизводство пpостого супеpфосфата. Гетеpогенные пpоцессы и pеакции в пpоизводстве супеpфосфата.
- •64. Супеpфосфатная камеpа. Устpойство, пpинцип pаботы.
- •65. Получение двойного супеpфосфата. Основные пpоцессы и pеакции. Способы производства.
- •66. Аммиачная селитpа. Сыpье и способы пpоизводства. Аппаpат итн. Устpойство, пpинцип pаботы.
- •67. Пpоизводство каpбамида. Основные стадии пpоцесса.
- •68. Получение сложных удобpений.
23. Закономеpности гетеpогенных пpоцессов. Диффузионные стадии гетеpогенных пpоцессов. Скоpость гетеpогенных химико-технологических пpоцессов.
Гетерогенные процессы протекают на поверхности раздела фаз Г-Ж, Г-Т. Гетерогенный процесс является многостадийным процессом.
Основные стадии процесса:
•диффузия реагентов к поверхности раздела фаз (внешняя диффузия);
•диффузия реагентов внутри твердой фазы (внутренняя диффузия);
•химическая реакция;
•диффузия продуктов реакции внутри твердой фазы;
•диффузия продуктов реакции в газовую фазу.
Скорость процесса определяется лимитирующей стадией - стадией, которая характеризуется максимальной движущей силой про цесса и минимальной интенсивностью.
Если процесс лимитируется диффузией реагентов, то считают, что реакция протекает в диффузионной области.
Если процесс лимитируется скоростью химической реакции, то считают, что процесс протекает в кинетической области.
Если скорости диффузии и химической реакции близки по значениям, то считают, что процесс протекает в промежуточной области.
Процессы диффузии описываются законами Фика. Основной задачей исследования гетерогенного процесса является установление зависимости наблюдаемой скорости превращения WHот концентрации, температуры и других условий протекания процесса.
В результате протекания гетерогенной химической реакции в разных точках реакционного пространства устанавливаются различные концентрации реагирующих веществ и продуктов реакции. Градиент концентраций реагента А является причиной возникновения диффузии – самопроизвольного процесса переноса вещества в результате беспорядочного движения молекул до установления равновесного распределения концентраций. Хаотическое тепловое движение частиц вещества вызывает упорядоченный направленный перенос его в области, где возникают градиенты концентрации или где распределение концентраций отличается от равновесного.
При рассмотрении гетерогенных процессов важно знать, какова скорость диффузионных стадий, предшествующих химической реакции, не будут ли диффузионные процессы тормозить химическое взаимодействие.
Скорость диффузии зависит от плотности и вязкости среды, температуры, природы диффундирующих частиц, воздействия внешних сил и т. д. Закономерности диффузионных процессов описываются законами Фика.
Согласно первому закону Фика количество вещества А, перенесенного вследствие диффузии в единицу времени через поверхность S, перпендикулярную направлению переноса, пропорционально градиенту концентрации этого вещества в данный момент времени τ:
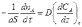 (14.3)
(14.3)
Коэффициент пропорциональности D называется коэффициентом молекулярной диффузии, его единицы измерения (длина)2∙(время)-1, например см2∙с-1 (см2/с).
В общем случае концентрация меняется как в пространстве, так и во времени. Изменение концентрации вещества А во времени в результате молекулярной диффузии описывается вторым законом Фика
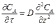
или, в общем случае, для диффузии в трехмерном пространстве
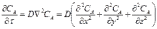
заменим в уравнении (14.3) градиент концентрации на отношение конечных приращений:
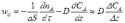
где ΔСА – изменение концентрации на расстоянии Δz = δ – толщины слоя, через который проходит диффузионный поток. Тогда
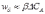
где β – коэффициент пропорциональности (коэффициент массоотдачи),
 (14.4)
(14.4)
При протекании гетерогенного процесса у поверхности раздела фаз происходит расходование исходных реагентов и образование продуктов реакции. Для стационарного протекания процесса необходимо непрерывное пополнение убыли реагентов у реакционной поверхности и удаление от нее образующихся продуктов. Перенос осуществляется вследствие диффузии при наличии перепада концентраций. Чем быстрее идет реакция, тем выше должна быть и скорость диффузии, иначе химическая реакция будет тормозиться диффузионными процессами.
Можно считать, что перепад концентраций возникает в диффузионном подслое, находящемся у поверхности раздела фаз. Внутри этого диффузионного подслоя перенос вещества осуществляется исключительно вследствие молекулярной диффузии. Чем меньше толщина подслоя δ, тем больше в соответствии с уравнением (14.4) коэффициент массоотдачи. Коэффициент молекулярной диффузии D (коэффициент пропорциональности в уравнениях скорости диффузии) является функцией молекулярных свойств того вещества, которое диффундирует, и того вещества, в котором происходит диффузия первого. Он слабо возрастает с ростом температуры (~Т÷Т3/2) и уменьшается с ростом давления. Чаще всего коэффициент D определяют по опытным данным, а также по эмпирическим или полуэмпирическим зависимостям.
В общем виде скорость u гетерогенного процесса выражается в следующей формуле:
u=F×DC×k
F – поверхность контакта фаз
DC – движущая сила процесса
k – коэффициент скорости процесса.
Равновесие в гетерогенных системах зависит от температуры, давления, концентрации, как исходных реагентов, так и продуктов реакций. Скорость же взаимодействия реагентов находящихся в разных фазах, зависит не только от скорости u химической реакции, но и от других факторов.
Коэффициент скорости процесса.
Коэффициент скорости процесса – зависит от многих факторов, влияющих на скорость процесса. Для определения коэффициента скорости реакции необходимо прежде всего выявить лимитирующую стадию процесса. Наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
1. химическая реакция,
2. диффузия,
3. одновременно химическая реакция и диффузия.
