
- •ГЛАВА 1
- •ГЛАВА 2
- •МОРФОЛОГИЯ РАНЕВОГО ПРОЦЕССА
- •2.2.1 МОРФОЛОГИЯ ОГНЕСТРЕЛЬНОЙ РАНЫ
- •2.2.2. МОРФОЛОГИЯ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •ГЛАВА 3
- •3. 1. МИКРОЦИРКУЛЯЦИЯ ПРИ РАНЕВОМ ПРОЦЕССЕ
- •3.2.1 КАЛЛИКРЕИН-КИНИНОВАЯ СИСТЕМА
- •3.2.2. БИОГЕННЫЕ АМИНЫ
- •3.2.3 СИСТЕМА КОМПЛЕМЕНТА
- •3.3. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ В РАНЕ
- •3.3.2. ГЛИКОЗАМИНОГЛИКАНЫ (МУКОПОЛИСАХАРИДЫ)
- •ГЛАВА 4
- •СИСТЕМА ГЕМОСТАЗА ПРИ РАНЕВОЙ ИНФЕКЦИИ
- •4.1. РОЛЬ ОБЩИХ И МЕСТНЫХ ФАКТОРОВ ГЕМОСТАЗА ПРИ РАНЕВОМ ПРОЦЕССЕ
- •4.2. ЛОКАЛЬНАЯ ГНОЙНАЯ ИНФЕКЦИЯ И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •4.3. ХИРУРГИЧЕСКИЙ СЕПСИС И СИСТЕМА ГЕМОКОАГУЛЯЦИИ
- •ГЛАВА 5
- •5.1. МИКРОБИОЛОГИЧЕСКИЕ АСПЕКТЫ РАНЕВОЙ ИНФЕКЦИИ
- •5.2.3. СЛУЧАЙНЫЕ РАНЫ
- •5.3. ХАРАКТЕРИСТИКА ОСНОВНЫХ ВОЗБУДИТЕЛЕЙ РАНЕВОЙ ИНФЕКЦИИ
- •5.4. КОМПЛЕКСНОЕ БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ БИОПТАТОВ ГНОЙНЫХ РАН
- •5.4.1. БАКТЕРИОЛОГИЧЕСКИЙ КОНТРОЛЬ МИКРОФЛОРЫ ПРИ ХИРУРГИЧЕСКОЙ ОБРАБОТКЕ ГНОЙНЫХ РАН
- •ГЛАВА 6
- •6.2.2. ОПСОНИЗАЦИЯ
- •6.2.3. ФАГОЦИТОЗ
- •6.2.4. ФУНКЦИЯ ЛИМФОЦИТОВ
- •6.2.5. СЫВОРОТОЧНЫЕ ФАКТОРЫ
- •ГЛАВА 7
- •КЛИНИКА РАНЕВОГО ПРОЦЕССА
- •7.1. КЛАССИФИКАЦИЯ РАН
- •7.2. КЛАССИФИКАЦИЯ РАНЕВОГО ПРОЦЕССА
- •7.4. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.4.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.4.2. СКОРОСТЬ ЗАЖИВЛЕНИЯ РАНЫ
- •7.4.3. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
- •7.4.5. МЕСТНАЯ ГЕМОСТАТИЧЕСКАЯ РЕАКЦИЯ
- •7.4.6. БИОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ РАНЕВОГО ЭКССУДАТА
- •7.4.7. ИССЛЕДОВАНИЕ ЭЛЕКТРОПОТЕНЦИАЛОВ ОБЛАСТИ РАНЫ
- •7.4.8. ИНФРАКРАСНАЯ ТЕРМОГРАФИЯ РАНЫ
- •7.4.9. СОСТОЯНИЕ МИКРОЦИРКУЛЯЦИИ
- •7.4.10. КРИТЕРИИ ЖИЗНЕСПОСОБНОСТИ ТКАНЕЙ РАНЫ
- •7.4.11. СИЛА НАТЯЖЕНИЯ РАНЫ
- •7.4.12. НАПРЯЖЕНИЕ РЕСПИРАТОРНЫХ ГАЗОВ В ОБЛАСТИ РАНЫ
- •7.4.14. ФЕРМЕНТАТИВНЫЕ ИЗМЕНЕНИЯ
- •7.5. ЗАЖИВЛЕНИЕ РАНЫ ПЕРВИЧНЫМ НАТЯЖЕНИЕМ
- •7.5.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6. ЗАЖИВЛЕНИЕ ГНОЙНОЙ РАНЫ, ЗАКРЫТОЙ ШВАМИ
- •7.6.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.6.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •7.7 ЗАЖИВЛЕНИЕ РАНЫ ВТОРИЧНЫМ НАТЯЖЕНИЕМ
- •7.7.1. КЛИНИЧЕСКАЯ КАРТИНА
- •7.7.2. ОБЪЕКТИВНЫЕ КРИТЕРИИ ОЦЕНКИ ТЕЧЕНИЯ РАНЕВОГО ПРОЦЕССА
- •ГЛАВА 8
- •МЕСТНОЕ ЛЕЧЕНИЕ ГНОЙНЫХ РАН
- •8.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •8.1.1. ХИРУРГИЧЕСКАЯ ОБРАБОТКА ГНОЙНОЙ РАНЫ
- •8.1.1.1. Терминология и основные понятия
- •8.1.1.3. Предоперационная подготовка и обезболивание
- •8.1.1.4. Техника хирургической обработки гнойного очага
- •8.1.2.3. Обработка гнойной раны лучами лазера
- •8.1.2.4. Обработка гнойной раны ультразвуком
- •8.1.4. ЗАКРЫТИЕ ГНОЙНОЙ РАНЫ
- •8.1.4.1. Наложение швов на гнойную рану
- •8.1.4.2. Кожная пластика гнойной раны
- •8.2. МЕСТНАЯ ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
- •8.2.1. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ В I ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •8.2.1.1. Антимикробные препараты
- •8.2.1.2. Некролитические препараты
- •8.2.2. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ГНОЙНОЙ РАНЫ ВО II ФАЗЕ РАНЕВОГО ПРОЦЕССА
- •ОБЩЕЕ ЛЕЧЕНИЕ РАНЕВОЙ ИНФЕКЦИИ
- •9.1 ХИМИОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.1.2. ВЫБОР АНТИБИОТИКА
- •9.1.3. КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
- •9.1.4. ОСЛОЖНЕНИЯ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
- •9.2. ИММУНОТЕРАПИЯ РАНЕВОЙ ИНФЕКЦИИ
- •9.2.1. ОБЩИЕ ПРИНЦИПЫ ИММУНОТЕРАПИИ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •9.2.3. ИММУНОКОРРЕКЦИЯ КЛЕТОЧНЫМИ ПРЕПАРАТАМИ КРОВИ
- •9.2.4. АКТИВНАЯ ИММУНИЗАЦИЯ
- •9.2.5. ИММУНОМОДУЛЯЦИЯ
- •9.3.2. ПРИМЕНЕНИЕ ИНГИБИТОРОВ ПРОТЕАЗ
- •9.3.4. ПРИМЕНЕНИЕ ГЕМОСТАТИЧЕСКИХ ПРЕПАРАТОВ
- •10.1. ИСТОРИЯ ВОПРОСА
- •10.2. МЕТОДИКА ЛЕЧЕНИЯ
- •10.4. ЛЕЧЕНИЕ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ
- •10.4.1. ОБШИРНЫЕ ГНОЙНЫЕ РАНЫ
- •10.4.2. ЛОКАЛЬНЫЕ ОЖОГИ
- •10.4.7. РОЖИСТОЕ ВОСПАЛЕНИЕ
- •10.5. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
- •ГЛАВА 11
- •ОСОБЫЕ ВИДЫ РАНЕВОЙ ИНФЕКЦИИ
- •11.1. КЛОСТРИДИАЛЬНАЯ РАНЕВАЯ ИНФЕКЦИЯ
- •11.2. АНАЭРОБНАЯ НЕКЛОСТРИДИАЛЬНАЯ ИНФЕКЦИЯ
- •11.4. СТОЛБНЯК
- •11.5. РОЖА
- •11.6. АКТИНОМИКОЗ
- •11.7. СИБИРСКАЯ ЯЗВА
- •11.8. ДИФТЕРИЯ РАН
- •11.9. СИФИЛИС РАН
- •11.10. ТУБЕРКУЛЕЗ РАН
- •ГЛАВА 12
- •12.2.1. ВОЗБУДИТЕЛИ
- •12.3. МОРФОЛОГИЯ
- •12.5. ОСЛОЖНЕНИЯ СЕПСИСА
- •12.6. ЛЕЧЕНИЕ
- •12.6.1. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ГНОЙНЫХ ОЧАГОВ
- •12.7. ИНТЕНСИВНАЯ ТЕРАПИЯ БОЛЬНЫХ С ТЯЖЕЛОЙ ГНОЙНОЙ ИНФЕКЦИЕЙ
- •12.7.1. ОБЩИЕ ПРИНЦИПЫ
- •12.7.2. ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА И ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •12.7.3.3. Детоксикация при тяжелой гнойной инфекции
- •12.7.3.5. Коррекция нарушений системы гемокоагуляции
- •12.7.3.6. Коррекция функций жизненно важных органов
- •12.7.5. ЛЕТАЛЬНОСТЬ ПРИ СЕПСИСЕ
- •ГЛАВА 13
- •ИЗМЕНЕНИЯ НЕРВНОЙ СИСТЕМЫ ПРИ ТЯЖЕЛОЙ РАНЕВОЙ ИНФЕКЦИИ
- •14.1. ОСОБЕННОСТИ ТЕЧЕНИЯ ГНОЙНОЙ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
- •14.2. НАРУШЕНИЯ ОБМЕНА
- •14.3. АКТИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- •14.4. КОМПЛЕКСНАЯ ТЕРАПИЯ
- •ГЛАВА 15
- •ОБЩИЕ ПРИНЦИПЫ АКТИВНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГНОЙНЫХ РАН И ГНОЙНЫХ ХИРУРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
в среднем 103—104 или менее в ходе оперативного вмешательства она снижается до минимальных значений.
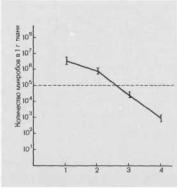
Вакуумная обработка до хирургического вмешательства заметно не уменьшает количество микробов в ране (см. рис. 8.13), поэтому мы производим ее до иссечения раны (или гнойника) только как подготовительный этап к операции при особенно загрязненных ранах, а после хирургической обработки повторяем вакуумирование вновь.
Изучение исходов заживления ран у больных, которым после хирургической обработки и вакуумирования проводили наложение швов (первичных или первичных отсроченных), показало, что число нагноений составило 6—8 % в зависимости от состояния раны и уровня первоначальной обсемененности. Нагноение всей раны, потребовавшее ее полного раскрытия, развилось только у 1,3 % против 11,5 % больных, которым не выполняли вакуумирования раны.
Данные наших клинико-бактерио- логических исследований свидетельствуют, что вакуумирование является эффективным методом усовершенствования хирургической обработки ран.
8.1.2.3. Обработка гнойной раны лучами лазера
Внедрение в хирургическую практику методов лазерного облучения побудило исследователей к их апробации при лечении гнойной раны. В нашей стране созданы лазерные
Рис. 8.13. Изменение количества микробов в ходе хирургической об-
работки |
раны |
и |
вакуумирования. |
|
1 — исходный |
уровень; |
2 — после |
||
предварительного |
вакуумирования; |
|||
3 — после |
хирургической |
обработки |
||
раны; 4 — после заключительного вакуумирования.
хирургические установки с наполнением углекислым газом («Скальпель», «Разбор»). Используя высокую энергетическую мощность СОг-лазеров, некоторые авторы применяют сфокусированный луч лазера в качестве «светового скальпеля» [Хромов Б. М., 1973; Вишневский А. А., 1973; Скобелкин О. К. и др., 1980; Aronoff В., 1983; Bellina Т., 1983]. Его преимуществами считают быстрое одномоментное удаление всех пораженных тканей при незначительной кровопотере благодаря эффекту фотокоагуляции, малую травматизации) тканей, стерилизующее действие на раневую поверхность, благоприятное течение послеоперационного периода [Плетнев С. Д. и др., 1983; Скобелкин О. К. и др., 1984; Gallet В., 1983; Aseher P. et al., 1983].
По данным О. К. Скобелкина и соавт. (1983), сфокусированный луч лазера вызывает в месте воздействия на ткани мгновенное вскипание и испарение жидкой части с обугливанием плотных субстанций. При этом можно эффективно удалять гнойно-некроти- ческие ткани с поверхности ран, что приводит к сокращению экссудативной фазы воспаления и ускоряет заживление ран. Экспериментально и клинически доказано, что толщина коагуляционного некроза составляет около 50 мкм [Смольянинов М. В., 1979; Дербенев В. А., 1983].
В противоположность этому С. Д. Плетнев и соавт. (1983) различают две зоны патоморфологических изменений. По их данным, ширина зоны коагуля-
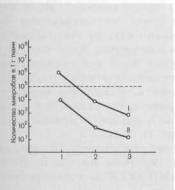
Рис. 8.14. Изменение количества микробов в процессе операции и вакуумирования в зависимости от исходного уровня обсемененности раны.
Г—при обсемененности выше 105; It—при обсемененности 103—104 на
1 г ткани; 1 — исходный уровень;
2 — после хирургической обработки;
3 — после хирургической обработки и вакуумирования.
ционного |
некроза |
составляет |
295— |
1983; Krueger |
R., Almquist |
E. 1985]. |
||
440 |
мкм. Последующая зона деструк- |
M. Treat и соавт. (1983) наблюдали |
||||||
тивных |
изменений |
толщиной |
600— |
повреждающее |
действие |
СОг-лазера |
||
900 |
мкм характеризуется выражен- |
на внутренние слои стенки сосуда в |
||||||
ностью |
альтернативных |
изменений, |
зоне, непосредственно не связанной с |
|||||
местами |
с сохранением |
структуры |
его воздействием. |
|
||||
тканей. Сходные результаты получили |
Результаты |
морфологических |
ис- |
|||||||||||||
Т. Bellina и G. Sebo (1980), S. Stellar |
следований |
ран |
после |
воздействия |
||||||||||||
(1980), |
М. Willseher |
и соавт. |
(1980). |
«светового скальпеля» крайне разно- |
||||||||||||
По данным М. В. Смольянинова |
речивы. |
При |
первых экспериментах, |
|||||||||||||
(1979), О. К. Скобелкина и соавт. |
выполненных |
в |
Институте |
хирургии |
||||||||||||
(1981), |
|
после |
лазерной |
обработки |
им. А. В. Вишневского АМН СССР, |
|||||||||||
стерилизация |
раневой |
поверхности |
была обнаружена возможность зажив- |
|||||||||||||
достигается в 81—90 % наблюдений. |
ления лазерных ран в отсутствие лей- |
|||||||||||||||
В. А. Дербенев |
(1983), В. М. Чегин и |
коцитарной |
инфильтрации |
тканей |
||||||||||||
соавт. (1983) отмечают снижение ко- |
[Галанкин В. Н. и др., 1979]. В даль- |
|||||||||||||||
личества микробов в 1 г ткани с 106 — |
нейшем В. Н. Галанкин и К. В. |
|||||||||||||||
109 до 103—104 после хирургической |
Боцманов (1984) в эксперименте пока- |
|||||||||||||||
обработки, а после применения ССЬ- |
зали, |
|
что |
рана |
паренхиматозных |
|||||||||||
лазера оно составило 101 —103 . В тече- |
органов (в частности, печени) после |
|||||||||||||||
ние 3 сут после операции количество |
воздействия |
сфокусированным |
лучом |
|||||||||||||
микробов в 1 мл диализата из дренажа |
ССЬ-лазера может заживать двумя |
|||||||||||||||
увеличивается до 10 , а стерильность |
путями. Один путь, наиболее часто |
|||||||||||||||
отделяемого из зашитой раны насту- |
встречающийся, |
включает |
обязатель- |
|||||||||||||
пает к 4—5-м суткам. |
|
|
|
ную фазу лейкоцитарного расплавле- |
||||||||||||
По мнению O.K. Скобелкина и соавт. |
ния |
некротических |
тканей. |
Другой, |
||||||||||||
(1981), С. Д. Плетнева и соавт. (1983), |
очень |
редко |
наблюдающийся |
вариант |
||||||||||||
хирургическая обработка раны |
«лазер- |
(4 из 48 наблюдений) заживления |
||||||||||||||
ным |
скальпелем» |
в |
большинстве |
связан со снижением или отсутствием |
||||||||||||
случаев протекает бескровно за счет |
хемотаксической |
активности |
повреж- |
|||||||||||||
эффекта фотокоагуляции и мгновен- |
денной |
ткани |
либо |
отсутствием |
||||||||||||
ного «заваривания» сосудов, а время |
микробов и характеризуется выпаде- |
|||||||||||||||
операции |
составляет |
в среднем |
10— |
нием фазы лейкоцитарного расплавле- |
||||||||||||
15 мин. В противоположность этому, |
ния. В опытах с удалением кожи |
|||||||||||||||
имеются |
сообщения |
об |
отсутствии |
сфокусированным лучом лазера также |
||||||||||||
гемостаза при использовании СОг- |
отмечена лейкоцитарная |
инфильтра- |
||||||||||||||
лазера, если диаметр сосудов превы- |
ция, хотя и менее интенсивная, чем |
|||||||||||||||
шает 1—2 мм [Нечай А. И. и др., |
при обнаружении микрофлоры в нек- |
|||||||||||||||
1985; |
Peterson |
M., |
1982; Swain |
S., |
ротических тканях. |
|
|
|
|
|||||||
По мнению М. В. Смольянинова (1979),О.К.Скобелкинаисоавт. (1981) результаты операций после лазерной некрэктомии зависят от фазы течения раневого процесса. В эксперименте установлено, что при иссечении гнойного очага «лазерным скальпелем» в фазе воспаления с последующим закрытием раны первичными швами, несмотря на полное удаление всех некротических тканей, на 3—5-е сутки выявляется выраженное нагноение с распространением лейкоцитарной инфильтрации на окружающие участки тканей. Однако применение расфокусированного луча СОг-лазера для подготовки экспериментальной раны к закрытию вторичными швами с сохранением грануляционной ткани показало, что уже на 7-е сутки поверхность раны полностью эпителизируется.
Анализируя результаты заживления ран после лазерной некрэктомии с наложением швов во II фазе раневого процесса, В. М. Смольянинов (1979) не выявил существенной разницы в процессе регенерации по сравнению с хирургической обработкой гнойной раны обычным скальпелем и последующим закрытием ее вторичными швами.
В последнее время появились сообщения о наложении первичного шва после использования «лазерного скальпеля» [Дербенев В. А., 1983; Чегин В. М. и др., 1986]. Авторы применяли сфокусированный луч лазера для р а с с е ч е - ния гнойного очага, иссечения и испарения пораженных тканей. По их мнению, образующаяся при этом на стенках раны зона коагуляционного некроза толщиной 30—50 мкм, не оказывает отрицательного влияния на течение раневого процесса, и уже к 7-му дню после наложения швов ожоговый струп замещается соединительной тканью. Нагноение ран отмечено у 3% оперированных (из 106).
В то же время А. И. Нечай и соавт. (1985) в эксперименте при рассечении «световым скальпелем» стенки желудка обнаружили в прилежащих к ране тканях различные по величине полости, выполненные некротическими массами. По их мнению, эта зона «бокового
некроза» представляет опасность вследствие того, что неизвестна ее распространенность на окружающие ткани. При наложении швов через эту зону в первые 2—3 сут после операции в эксперименте отмечается их несостоятельность. В клинике осложнения, непосредственно связанные с воздействием СОг-лазера, отмечены авторами у 6 из 31 больного.
В отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского АМН СССР изучены результаты лечения 46 больных с острыми гнойными заболеваниями мягких тканей и длительно не заживающими ранами при использовании лазерной установки «Ромашка-1». Техника операции не отличалась от описанной О. К. Скобелкиным и соавт. (1980).
И с с е ч е н и е г н о й н о г о очага производили сфокусированным лучом лазера, дополняя вмешательство «выпариванием» раневой поверхности расфокусированным лучом. Время, затраченное на оперативное вмешательство и гемостаз, составило при карбункулах 17—22 мин, при абсцессах и флегмонах — 30—45 мин и возрастало при обширных флегмонах. Кровопотеря во время операции была обычной, как при работе со скальпелем или электроножом. Из 46 больных 7 повторно оперированы через 30—60 мин в связи с кровотечением из раны. При этом обнаружены артериальные и венозные сосуды диаметром 1 —1,5 мм, т. е. эффекта фотокоагуляции не наступило.
Как и другие исследователи, мы отметили высокие стерилизующие свойства СОг-лазера. Если после хирургической обработки обычным скальпелем количество микробов в ране уменьшилось с 106—107 до 103—104 в 1 г ткани, то после лазерного воздействия — до 101 (рис. 8.15). В подлежащих коагуляционному струпу тканях количество микробов снижалось до 101, а в 87% наблюдений рост микрофлоры не обмечается. Однако начиная с 1 — 2-х суток после операции количество микробов возрастало, достигая к 3 — 5-м суткам 105 — 106 в 1 г ткани или 1 мл отделяемого, т.е. превышало
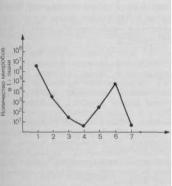
Рис. 8.15. Динамика количественного содержания микрофлоры в 1 г ткани после хирургической
обработки |
и |
иссечения |
гнойного |
||
очага «световым скальпелем». |
|||||
По |
оси |
абсцисс — этапы |
исследова- |
||
ния: |
1 — до |
операции; 2 — после хи- |
|||
рургической |
|
обработки |
скальпелем; |
||
3 — на поверхности раны |
и 4 — под |
||||
струпом; |
3 |
и |
4 — после |
воздействия |
|
лазером; |
5 — 1 — 2-е сутки после опе- |
||||
рации; 6 — 3—4-е сутки после операции; 7 — после повторной операции.
критический уровень. По дренажам в |
свежих эритроцитов (рис. 8.16,6). Сох- |
|||||||||||||||||
эти сроки отделялось большое количе- |
раняется выраженный отек межкле- |
|||||||||||||||||
ство гнойно-некротических масс (у 12 |
точных прослоек в подкожной жиро- |
|||||||||||||||||
из 17 больных с первичными и первич- |
вой клетчатке и межмышечной соеди- |
|||||||||||||||||
ными отсроченными швами). Такая |
нительной |
ткани |
с |
|
накоплением |
|||||||||||||
обсемененность |
раны |
|
клинически |
ПМЯЛ. Выраженные нарушения кро- |
||||||||||||||
соответствовала проявлениям |
нагно- |
вообращения |
в |
зоне |
жизнеспособных |
|||||||||||||
ения раны у 16 из 30 (53 %) больных. |
тканей приводят к развитию мелких |
|||||||||||||||||
После операции по типу иссечения |
фокусов вторичного некроза и нагное- |
|||||||||||||||||
гнойного очага |
с ф о к у с и р о в а н - |
ния (рис. 8.16,в). Местами отмечается |
||||||||||||||||
ным |
лучом |
лазера гистологические |
деструкция отдельных мышечных во- |
|||||||||||||||
изменения в ране оказались сходными |
локон, коллагеновых волокон и других |
|||||||||||||||||
у всех больных, отличаясь лишь в |
соединительнотканных |
структур. |
В |
|||||||||||||||
деталях. В 1—2-е сутки после операции |
отдельных участках под струпом на- |
|||||||||||||||||
в краях раны сохранялись аморфные |
чинается |
формирование |
островков |
|||||||||||||||
обугленные массы диаметром от 20 до |
грануляций с небольшим количеством |
|||||||||||||||||
40 мкм и тонкий пласт коагулирован- |
активных |
фибробластов, |
лимфоцитов |
|||||||||||||||
ной крови, плотно спаянный с зоной |
и единичных ПМЯЛ. |
|
|
|
|
|
||||||||||||
коагуляционного некроза (рис. 8. 16, а). |
На 7—9-е сутки толщина слоя нек- |
|||||||||||||||||
Толщина последнего в одном и том же |
роза |
начинает |
уменьшаться |
(рис. |
||||||||||||||
препарате колеблется от 50 до 500 мкм, |
8.16, г). В ее глубоких слоях наблюда- |
|||||||||||||||||
что, по-видимому, обусловлено различ- |
ются |
немногочисленные |
лейкоциты |
и |
||||||||||||||
ной теплопроводностью тканей. Харак- |
единичные макрофаги, а также фиб- |
|||||||||||||||||
терно |
отсутствие |
четкой |
границы |
робласты. Демаркационный вал по- |
||||||||||||||
между зоной некроза и подлежащим |
прежнему |
отсутствует. |
|
Подкожная |
||||||||||||||
слоем |
жизнеспособных |
|
тканей, |
в |
жировая |
клетчатка |
покрыта |
слоем |
||||||||||
котором |
отмечаются |
выраженные |
фибрина и детрита, обильно инфиль- |
|||||||||||||||
нарушения кровообращения при на- |
трированных ПМЯЛ. В отечной жи- |
|||||||||||||||||
личии |
так |
называемых |
лазерных |
ровой и межмышечной соединитель- |
||||||||||||||
тромбов. Лейкоцитарная |
реакция |
по |
ной |
ткани наблюдается |
разрастание |
|||||||||||||
границе с некрозом снижена до |
молодых грануляций с очаговой ин- |
|||||||||||||||||
минимума: полиморфно-ядерные лей- |
фильтрацией их лейкоцитами. В жиз- |
|||||||||||||||||
коциты |
(ПМЯЛ) |
немногочисленны. |
неспособной ткани сохраняются нару- |
|||||||||||||||
Жировая и мышечная ткани отечны, |
шения кровообращения. |
|
|
|
|
|||||||||||||
с признаками |
деструкции |
отдельных |
На 10—14-е сутки встречаются |
|||||||||||||||
клеток вблизи зоны некроза. |
|
|
уча'стки жировой ткани со слоем коа- |
|||||||||||||||
На 3—5-е сутки после операции зона |
гуляционного |
некроза |
толщиной |
не |
||||||||||||||
коагуляционного некроза не изменяет- |
более 50—150 мкм (рис. 8.16,д). Не- |
|||||||||||||||||
ся, |
местами |
появляются |
скопления |
посредственно |
|
под |
ним |
происходит |
||||||||||
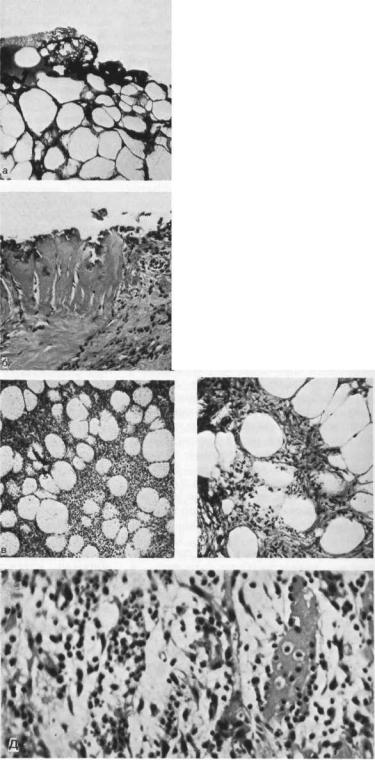
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 8.16. Гистофотограммы биоптатов и пунктатов раны после воздействия сфокусированным лучом СО2-лазера.
а — 1—2-е сутки после операции. Тонкий слой некротизированной бесструктурной ткани, местами покрытый свернувшейся кровью и многочисленными мелкими полостями в толще дермы (участки «вскипания»). Здесь и далее окраска гематоксилин эозином. Х56; б — 3—5-е сутки после операции. Слой некроза, нечетко отделенный от подлежащей ткани. На границе отмечается пролиферация фибробластов и круглоклеточных элементов местами,пролиферирующих в зону некроза. ХЮО.
в — 3—5-е сутки после операции. Вторичное нагноение жировой ткани. Х56; г — 7—9-е сутки после операции. Уменьшение толщины струпа с разрастанием под ним фибробластов при слабо выраженной макрофагальной реакции и внедрением макрофагов в струп. Х120; д -— 10—14-е сутки после вмешательства. Некроз и гнойное расплавление мышечной ткани с прорастанием в нее фиброблас тов. Х280.
разрастание грануляционной ткани, нередко образующей своеобразный демаркационный слой, отграничивающий зону некроза. Не исключено, что данная морфологическая картина отражает сущность процесса демаркации при данном способе иссечения раны.
Обширные участки подкожной жировой клетчатки покрыты фибрином
кам, и в старых склерозированных
грануляциях |
наблюдается |
выражен- |
||
ная |
инфильтрация |
ПМЯЛ, |
местами |
|
с |
формированием |
микроабсцессов. |
||
На 9—12-е |
сутки, |
как и |
при ис- |
|
пользовании «светового скальпеля», отмечается истончение некроза. По границе его с зоной некроза начинают накапливаться лимфоидные клетки (рис. 8.17,6). Отмечается постепенная
идетритом, инфильтрированными организация новообразованных грану-
ПМЯЛ. Подкожная жировая клетчатка и прилежащая мышечная ткань отечны, отделены от слоя фибрина отечными грануляциями, содержащими лимфоидные клетки, немногочисленные макрофаги и единичные плазматические клетки. В их глубоких слоях происходят пролиферация фибробластов и процессы неоколлагенеза. Одновременно в участках лейкоцитарной инфильтрации отечной соединительной ткани отмечаются разволокнение и глыбчатый распад коллагеновых волокон.
Ни в одном наблюдении не выявлены гигантские многоядерные клетки, которые резорбируют некротическую ткань, как наблюдали В. Н. Галанкин и К. В. Боцманов (1984) в процессе заживления ран паренхиматозных органов, нанесенных лучом СОг-лазера.
При длительно не заживающих ра-
нах |
операцию производили р а с ф о - |
|
к у с и р о в а н н ы м |
лучом лазера на |
|
фоне |
подострого |
или хронического |
воспаления. В 1—2-е сутки после операции в ране обнаруживается неравномерный (толщиной до 1000 мкм) слой коагуляционного некроза; граница его с подлежащей тканью не различима.
В некротизированной ткани и в зоне склерозированной подкожной и мышечной ткани изменения в целом идентичны наблюдавшимся при использовании сфокусированного луча лазера.
На 3—7-е сутки зона некроза не меняется (рис. 8.17,а), признаков демаркационного воспаления под ней также нет. В новообразованных грануляциях, начинающих формироваться под зоной некроза к 7-м сут-
ляций. Однако на этом фоне постоянно имеет место выраженная инфильтрация тканей нейтрофилами. В наших наблюдениях у 4 из 5 больных она сочеталась с нагноением раны. Лишь у одного больного при гнойном расплавлении рубца в его ткани были обнаружены гигантские многоядерные клетки резорбции. Демаркационный лейкоцитарный вал отсутствовал.
Гистологически выявлены некоторые закономерности заживления гнойных ран после их иссечения или «выпаривания» сфокусированным и расфокусированным лучом лазера. Прежде всего наблюдается замедленное отторжение некротической зоны при полном отсутствии лейкоцитарного демаркационного вала. По-видимому, его роль играет слой грануляций, постепенно образующийся под зоной некроза. Отсутствует также резорбция некротической ткани и детрита гигантскими многоядерными клетками. Резорбция в данном случае осуществляется, вероятно, лейкоцитами, которые ответственны также за экзоцитоз мертвой ткани. Эта функция ПМЯЛ доказана на модели ожоговой и гнойной раны Д. С. Саркисовым и соавт. (1984). Выраженные пролонгированные нарушения кровообращения в тканях жизнеспособной зоны способствуют их микробному обсеменению, лейкоцитарной инфильтрации и развитию вторичного некроза. Наличие в ткани продуктов клеточного распада и экзогенных микробных хематтрактантов, большого количества лаброцитов в грануляциях в поздние сроки обусловливает нагноение раны и заживление по типу вторичного натяжения.
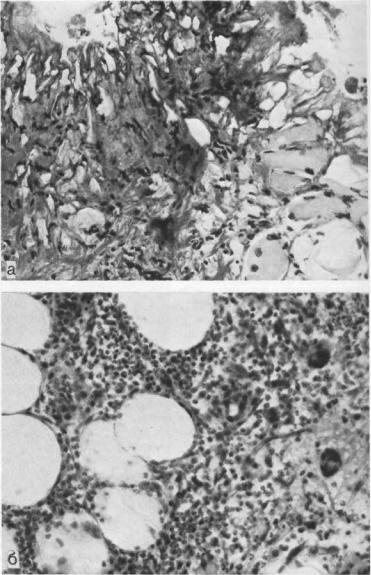
РАНЫ И РАНЕВАЯ ИНФЕКЦИЯ
Рис. 8.17. Гистофотограммы биоптатов раны после воздействия расфокусированным лучом лазера.
а — 3—7-е сутки после операции. Толстый струп, практически не отграниченный от окружающих тканей, с многочисленными пузырьками «вскипания». Х'^80; б — 9—12-е сутки после операции. Развитие флегмоны. Примесь круглоклеточных элементов в гнойном инфильтрате, местами единичные гигантские клетки резорбции. Х280.
