
2 курс / Гистология / Клиническая патология
.pdfместах ее расщепления эндонуклеазами (метод метки in situ уридиновыми основаниями - TUNEL-тест), и иммуногистохимические методы выявления некоторых каспаз, промоторов апоптоза и мембранных рецепторов, индуцирующих апоптоз. Микроскопические признаки апоптоза обнаруживают, как правило, в отдельных клетках. При подсчете апоптозных телец в тканевых срезах частота (индекс апоптоза) составляет десятые и тысячные доли процента. Морфологические признаки апоп-тоза складываются из изменений ядер, цитоплазмы и клеточной мембраны. Клетки приобретают округлую форму, теряют контакты с соседними клетками, сморщиваются, в них изрезанные, фрагментированные ядра с конденсированным под кариолеммой хроматином, сморщенная цитоплазма, они теряют микроворсинки и межклеточные мостики (десмосомные контакты).
При постановке TUNEL-теста ядерный хроматин клеток, вступивших в апоптоз, имеет специфическую флуоресценцию при использовании флуоресцентной метки или приобретает коричневое окрашивание в случае пероксидазной метки. TUNEL-тест выявляет клетки со сморщенными ядрами, с конденсированным хроматином звездчатой формы, клетки с интенсивно окрашенными пикнотичными ядрами, округлые апоптозные тельца.
Апоптозные тельца отличают небольшие размеры, сравнимые с размерами лимфоцитов с высоким ядерно-цитоплазматическим соотношением, округлыми контурами и конденсированными хроматином и цитоплазмой.
Один из наиболее информативных методов верификации апоптоза - электронная микроскопия. Клетки в состоянии апоптоза имеют следующие изменения их ультраструктуры.
•Отсутствие микроворсинок и межклеточных контактов. В отличие от некроза, речь идет всегда об изменениях в отдельных клетках.
•Уменьшение размеров и изменения формы клетки в связи с конденсацией цитоплазматических органелл. Часто клетка расщепляется на несколько апоптозных телец, каждое из которых имеет свой фрагмент ядра, ограниченный двухконтурной ядерной мембраной, и индивидуальный набор органелл.
•Сохранность и интегративность органелл. Митохондрии не набухают, в них сохраняются кристы. Характерны агрегация рибосом в полукристаллоидные структуры и появление пучков микрофиламентов под цитолеммой, расположенных параллельно мембране. Часто наблюдают расширение цистерн гладкого эндоплазматического ретикулума с формированием вакуолей, наполненных жидкостью, которая выводится из клетки. При сканирующей ЭМ на поверхности клетки видны крате-рообразные углубления.
•Конденсация ядерного хроматина под карио-леммой в виде полусфер и глыбок. В ядре видны осмиофильные тельца, сформированные транскрипционными комплексами,
поступающими из ядрышек. Ядро становится изрезанным, фрагментируется, ядерные поры концентрируются только в участках, где отсутствует маргинация хроматина.
• Фагоцитоз апоптозных телец соседними паренхиматозными и стромальными клетками, прежде всего макрофагами, но и другими клетками. Фагоцитоз происходит настолько быстро, что в условиях in vivo апоптозные клетки сохраняются лишь в течение нескольких минут, что затрудняет их наблюдение.
НАРУШЕНИЯ РЕГУЛЯЦИИ АПОПТОЗА И ЕГО КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ
Нарушение регуляции апоптоза приводит к возникновению дисбаланса между процессами митоза и гибели клеток в тканях, что воздействует на тканевый гомеостаз. Можно
выделить три варианта нарушений регуляции апоптоза, обнаруживаемых при различных заболеваниях:
•чрезмерный апоптоз (по сравнению с пролиферацией), что приводит к повышению клеточной гибели (например, при ВИЧ-инфекции, фульминантных формах гепатитов В и С) или к атрофии (нейродегенеративные заболевания, хроническая ишемия миокарда);
•недостаточный апоптоз по отношению к уровню пролиферации, что наблюдают при гиперпластических процессах, опухолевом росте, а также аутоиммунных болезнях. Снижение уровня апоптоза в тканях способствует выживанию мутировавших клеток и может привести к развитию опухолей. Недостаточный апоптоз «запрещенных» клонов В- лимфоцитов, активированных по каким-либо причинам, продуцирующих аутоантитела, может приводить к развитию аутоиммунных болезней;
•незавершенный апоптоз в связи с отсутствием фагоцитоза апоптозных телец обнаружен нами при раке легкого. Незавершенный апоп-тоз можно считать особенностью опухолевого роста. В ряде случаев апоптозные тельца могут подвергаться вторичному аутолизу за счет собственных лизосомальных ферментов с образованием постапоптозного детрита, неотличимого от некротического. В свою очередь незавершенный апоптоз с последующим ауто-лизом апоптозных телец, что приводит к выходу клеточных протоонкогенов, факторов роста, цитокинов, может стать источником митоген-ных факторов, стимулирующих пролиферацию опухолевых клеток. Таким образом, не исключено, что незавершенный апоптоз в опухоли легкого с последующим аутолизом апоптозных телец может стимулировать рост опухоли.
Значение апоптоза велико, поскольку запрограммированная клеточная гибель связана с большинством патологических процессов. Особое
значение апоптоз имеет при атрофии, иммунопатологических процессах, воспалении и опухолевом росте, причем при опухолях он может быть усилен с помощью химиотерапевтических и лучевых воздействий на опухолевую ткань.
Апоптоз может развиваться при повреждающем действии вирусов на клетки. Например, при вирусных гепатитах отмечают апоптоз гепатоци-тов - тельца Каунсилмена. Апоптоз клеток воспалительного инфильтрата наблюдают в очагах иммунного (лимфоциты) и гнойного (ПЯЛ) воспаления. Гибель В- и Т-лимфоцитов, а также клеток-мишеней в ходе реакций клеточного иммунитета и отторжения трансплантата также происходит путем апоптоза. В клетках корковой части тимуса при воздействии кортикостероидных гормонов и при формировании иммунологической толерантности также развивается апоптоз.
НЕКРОЗ
Некроз (от греч. necros - мертвый) - омертвение, гибель клеток и тканей в живом организме в ответ на повреждение, сопровождаемое активацией гидролитических ферментов и развитием аутолиза. Некроз может захватывать отдельные участки тела, целиком органы, ткани, группы клеток и отдельную клетку, а также часть клетки (фокальный некроз). Некроз развивается при действии повреждающего фактора, поэтому он возникает только в условиях патологии. Некроз может иметь самостоятельное значение, а также завершать или быть одним из важнейших элементов таких патологических процессов, как дистрофии, воспаление, расстройства кровообращения, опухолевый рост и др.
Этиология и патогенез некроза. Выделяют пять основных этиологических факторов некроза: травматический, токсический, трофоневротический, аллергический и сосудистый. Эти факторы могут оказывать или непосредственное действие на ткань, или опосредованное - через сосудистую, нервную и иммунную системы. Этиологический
Книга рекомендована к покупке и прочтению разделом по патофизиологии сайта https://medicalplanet.su/
принцип и лег в основу классификации видов некроза. По механизму действия этиологического фактора некроз может быть прямым и непрямым. Прямой
некроз может быть травматическим и токсическим. Непрямой некроз - трофоневротическим, аллергическим и сосудистым.
КЛАССИФИКАЦИЯ ВИДОВ НЕКРОЗА
• Травматический некроз - результат прямого действия на ткань физических (механических, температурных, вибрационных, радиационных и др.) и химических (кислот, щелочей и др.) факторов.
•Токсический некроз развивается при действии на ткани токсических факторов бактериальной и другой природы.
•Трофоневротический некроз развивается при нарушении циркуляции и иннервации тканей при заболеваниях центральной и периферической нервной системы. Примером трофонев-ротического некроза могут служить пролежни.
•Аллергический некроз - результат иммунного цитолиза тканей в ходе реакций гиперчувствительности немедленного и замедленного типов (ГНТ и ГЗТ соответственно). Классическим примером аллергического некроза при ГНТ с участием иммунных комплексов, содержащих комплемент, может служить фибриноид-ный некроз при феномене Артюса. Иммунный цитолиз с участием Т-лимфоцитов-киллеров и макрофагов приводит к развитию некроза ткани печени при хроническом активном гепатите.
•Сосудистый некроз связан с абсолютной или относительной недостаточностью циркуляции в артериях и венах. Наиболее частая форма сосудистого некроза обусловлена нарушением кровообращения в артериях в связи с их тромбозом, эмболией, длительным спазмом, а также с функциональным перенапряжением органа в условиях гипоксии. Недостаточная циркуляция в ткани вызывает ее ишемию, гипоксию и развитие ишемического некроза, патогенез которого связан не только с гипок-сическими, но и реперфузионными механизмами.
Ишемия - снижение или полное прекращение кровообращения в органах, в зависимости от степени выраженности и продолжительности вызывает развитие разных вариантов смерти клеток. При незначительной степени ишемии, а также при хроническом течении ишемизированные клетки подвергаются атрофии и апоптозу. При остро развивающейся выраженной ишемии в органах возникают различные варианты некроза - инфаркт и гангрена.
Ишемическую гибель клеток можно считать наиболее часто встречаемым вариантом. Она закономерно развивается в органах и тканях при различных заболеваниях сердца и сосудов (прежде всего, при ИБС), цереброваскулярных заболеваниях, атеросклерозе, ГБ и васкулитах.
Морфогенетическая особенность гибели клеток при ишемии обусловлена тем, что разрушение ультраструктур в результате аноксии начинается с повреждения митохондрий, что ведет к энергетическому дефициту, активации анаэробного гликолиза, нарушению работы ионных насосов и накоплению Са2+ в клетках, активации Са2+- зависимых фосфолипаз и протеаз, разрушающих мембраны.
Механизмы некроза (рис. 2.4) отличают от механизмов аутолиза, во многом они зависят от характера повреждающего фактора и структурно-функциональных особенностей клеток, тканей и
органов, в которых развивается некроз. Из всего многообразия патогенетических путей некроза наиболее значимыми являются: 1) связывание клеточных белков с убиквитином,
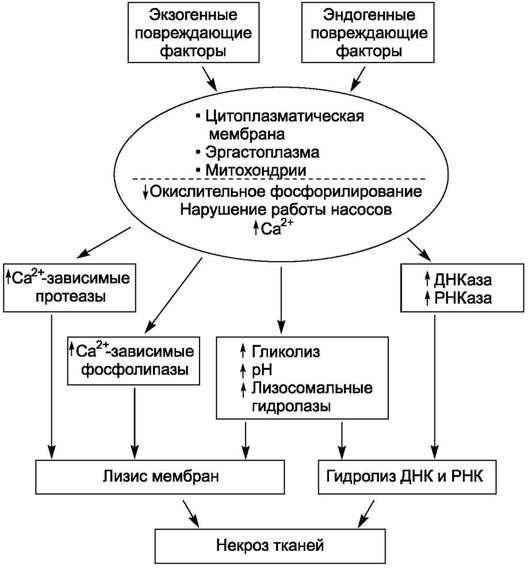
2) дефицит АТФ, 3) образование активных форм кислорода, 4) нарушение кальциевого гомеостаза и 5) потеря клеточными мембранами селективной проницаемости.
Рис. 2.4. Патогенетические механизмы некроза
Убиквитин - один из наиболее консервативных белков, в составе протеосом формирует ковалент-ные связи с остатками лизина полипептидных цепочек других белков. Синтез убиквитина, как и белков из семейства белков теплового шока, потенцирует различные повреждения. Так, в клетках ЦНС при болезни Альцгеймера и болезни Паркинсона, а также в гепатоцитах при алкогольном поражении печени обнаруживают протеосомы - комплексы белков с убиквитином. Такие комплексы в гепато-цитах известны как тельца Мэллори.
Дефицит АТФ постоянно развивается в гибнущих клетках. Долгое время полагали, что основная причина некроза кардиомиоцитов при ишемии - снижение образования макроэргических соединений до определенного уровня. B последние годы было показано, что в ишемическом повреждении участвуют и другие механизмы. Так, если ишемизированный миокард подвергнуть реперфузии,
то некротические изменения наступают гораздо быстрее и в больших масштабах. Описанные изменения были названы реперфузионными повреждениями. Использование ингибиторов кальция (таких как хлорпромазин) и антиоксидантов, несмотря на низкий
Книга рекомендована к покупке и прочтению разделом по патофизиологии сайта https://medicalplanet.su/
уровень АТФ, уменьшает реперфузионные повреждения, что указывает на то, что для развития некроза одного дефицита АТФ еще недостаточно.
Образование активных форм кислорода (синг-летный кислород, супероксид анионрадикал, анион гидроксила, пероксид водорода и др.) постоянно происходит в живых клетках. Bступая во взаимодействия с липидами мембран, молекулами ДНК, вызывая оксидативный стресс, активные формы кислорода повышают проницаемость мембран, ингибируют катионные насосы, потенцируют дефицит АТФ и избыток внутриклеточного кальция, что приводит к развитию повреждения клетки и ткани. Наибольшее значение активные формы кислорода играют в патогенезе некроза пневмоцитов при дистресссиндроме новорожденных, развивающемся в результате оксигенотера-пии, реперфузионных повреждений при инфаркте миокарда и некрозе гепатоцитов при передозировке парацетамола.
Нарушения кальциевого гомеостаза характеризуют накоплением внутриклеточного кальция в гибнущих клетках. В живых клетках внутриклеточная концентрация ионов кальция примерно в тысячу раз меньше, чем внеклеточная. Начальные изменения при повреждении связаны с нарушением работы катионных помп в связи с дефицитом АТФ. При этом кальций накапливается внутри клеток, прежде всего в митохондриях. Происходит активация Са2+-зависимых протеаз и фосфолипаз, что приводит к необратимым повреждениям мембран (митохондриальных, цитоплазматических), к еще большим нарушениям их проницаемости и гибели клетки.
Потеря способности к избирательной проницаемости цитоплазматических мембран - один из характерных признаков некроза при воздействии комплемента, вирусных инфекциях и гипоксиче-ских повреждениях. При этом происходит повреждение трансмембранных белков, рецепторов и ферментных систем, регулирующих транспорт в клетку определенных веществ. При воздействии комплемента и перфоринов в цитоплазматическую мембрану встраиваются протеиновые полимера-зы. Литические вирусы также взаимодействуют с липидами мембран, встраивают в них белки вирусных капсидов, что приводит к разрушению цитоплазматических мембран в момент выхода вируса из инфицированной клетки. В клетках, подвергшихся ишемии, нарушено расположение трансмембранных белков с формированием характерных белковых «гипоксических» уплотнений.
Морфогенез некроза. Некротический процесс проходит ряд морфогенетических стадий: паранекроз, некробиоз, гибель клетки, аутолиз.
•Паранекроз характеризуют появлением изменений, подобных некротическим, но обратимых.
•Некробиоз - развитие необратимых дистрофических изменений, характерное преобладанием катаболических реакций над анаболическими.
•Гибель клетки, время наступления которой установить трудно.
•Аутолиз - разложение мертвого субстрата под действием гидролитических ферментов погибших клеток и клеток воспалительного инфильтрата.
Критерии гибели клетки. Установление момента гибели клетки имеет важное теоретическое и клиническое значение при решении вопроса о жизнеспособности тканей, подлежащих хирургическому удалению, а также в трансплантологии. Однозначного ответа на этот вопрос пока нет. В токсикологической практике критерием жизнеспособности тканей является, например, сохранение способности клеток к пролиферации. Но можно ли считать клетку погибшей, если она находится в фазе покоя, может дифференцироваться и быть жизнеспособной еще долгое
время, как это и происходит с большинством клеток многоклеточных организмов?
Предлагают также использовать для установления гибели клеток и тканей метод in
vitro, основанный на захвате ими различных красителей (трипанового синего и др.). Метод захвата краски также не может служить достоверным критерием оценки гибели клетки, так как скорее связан с повреждением цитоплазматической мембраны, а не с некрозом. Как видно, достоверных функциональных тестов для установления момента гибели клеток пока еще не разработано.
Для определения гибели клетки наиболее часто используют морфологические критерии. Такие достоверные критерии необратимости повреждения клетки при электронной микроскопии - отложения в митохондриях электронно-плотных депозитов, содержащих белки и соли кальция, и разрушение их внутренних мембран. При световой микроскопии изменения в структуре клетки становятся видимыми лишь на стадии аутолиза. Поэтому, говоря о микроскопических признаках некроза, по существу, имеют в виду морфологические изменения клеток на стадии аутолиза.
Морфология некроза. Общими для всех форм некроза считают изменения цвета, консистенции и в ряде случаев - запаха некротических тканей. Некротизированная ткань может иметь плотную и сухую консистенцию, что наблюдают при коагуляционном некрозе. Ткань при этом может мумифицироваться. В других случаях мертвая
ткань дряблая, содержит большое количество жидкости, подвергается миомаляции (от греч. malakas - мягкий). Такой некроз по консистенции называют колликвационным.
Цвет некротических масс зависит от наличия примесей крови и различных пигментов, а также обусловлен развитием на границе между мертвой и живой тканью зоны демаркационного воспаления, имеющей красно-бурый цвет. Мертвая ткань бывает белой или желтоватой, нередко окружена красно-бурым венчиком. При пропитывании некротических масс кровью они могут приобретать цвет от красного до бурого, желтого и зеленого (в зависимости от преобладания тех или иных гемоглобинных пигментов). В некоторых случаях фокусы некроза прокрашиваются желчью. При гнилостном расплавлении мертвая ткань издает характерный дурной запах.
Микроскопические признаки некроза (рис. 2.5- 2.8, см. цв. вклейку) выявляют в изменениях как ядра, так и цитоплазмы. Ядра последовательно подвергаются сморщиванию (кариопикноз), распаду на глыбки (кариорексис) и лизируются (кариолизис). Эти изменения ядер связаны с активацией гидролаз - рибонуклеаз и дезоксирибонуклеаз.
В цитоплазме происходит денатурация и коагуляция белков, а затем колликвация. Коагуляция цитоплазмы сменяется распадом ее на глыбки (плазморексис) и лизисом органелл (плазмолизис). При фокальных изменениях говорят о фокальном коагуляционном некрозе и фокальном колликва-ционном некрозе (баллонная дистрофия).
Некроз развивается не только в паренхиматозных элементах тканей и органов, но и в их строме. При этом происходит разрушение как клеток, так и нервных окончаний и компонентов межклеточного матрикса. Расщепление ретикулярных, коллагеновых и эластических волокон происходит с участием нейтральных протеаз (коллагеназ, эластазы), гликопротеинов под действием проте-аз, липидов - липаз. При световой микроскопии наблюдают распад, фрагментацию и лизис ретикулярных, коллагеновых и эластических волокон (эластолизис), в некротизированной ткани нередко откладывается фибрин. Такие изменения характерны для фибриноидного некроза. В жировой ткани некроз носит специфические черты в связи с накоплением в некротических массах жирных кислот и мыл, что ведет к образованию липогранулем.
Некрозу сопутствует развитие местного демаркационного острого воспаления, связанного с выделением некротизированной тканью провос-палительных субстанций. Природа этих веществ пока недостаточно изучена. Есть указания на выработку погибающими клетками
Книга рекомендована к покупке и прочтению разделом по патофизиологии сайта https://medicalplanet.su/
лейкотрие-нов - мощных медиаторов воспаления, образующихся при перекисном окислении липидов. Кроме того, компоненты, освобождающиеся при повреждении митохондрий, - сильные активаторы системы комплемента. Сама воспалительная реакция на некроз может вызвать дополнительные повреждения сохранившихся в зоне демаркационного воспаления клеток и тканей. Это особенно важно при некрозе (инфаркте) миокарда, когда некроз кардиомиоцитов обнаруживают не только в зоне некроза, но и в зоне перифокального воспаления, что значительно увеличивает площадь некроза миокарда. Повреждение кардиомиоцитов в зоне демаркационного воспаления обусловлено как реперфузией, так и действием протеаз клеток воспалительного инфильтрата - прежде всего ПЯЛ и макрофагов, и активных форм кислорода.
Реакция на некроз может быть не только местной, но и системной, которая связана с синтезом клетками печени двух белков острой фазы воспаления - С-реактивного белка и плазменного белка SAA. Концентрация С-реактивного белка повышена в плазме при различных видах повреждения. Этот белок аккумулируется в некротических массах и может активировать комплемент по классическому пути и инициировать развитие демаркационного воспаления. Роль белка SAA,
который может попадать в кровь из очагов некроза, связана с опсонизированием хроматина. Этот белок может стать белком-предшественником при формировании ААамилоида.
УЛЬТРАСТРУКТУРНЫЕ ПРИЗНАКИ НЕКРОЗА
Электронно-микроскопические признаки некроза отражают изменения органелл клетки.
•Ядро характеризуют агрегацией хроматина, фрагментацией ядерной мембраны, полным разрушением.
•Митохондрии набухают, уменьшается плотность гранул матрикса, образование в нем агрегатов неправильной формы, отложение солей кальция.
•Эндоплазматическая сеть также набухает, фрагментируются и распадаются мембранные структуры.
•Полисомы и рибосомы - распад полисом, отделение рибосом от поверхности цистерн эндо-плазматического ретикулума, уменьшение четкости контуров и размеров, а также количества рибосом.
•Лизосомы - агрегация мелких плотных гранул матрикса и его просветление, разрыв наружной мембраны.
•Цитоплазматический матрикс характеризуют исчезновением гранул гликогена, снижением активности ферментов.
Клинико-морфологические формы некроза выделяют в зависимости от морфологических особенностей и клинических проявлений той или иной его формы, что определяют этиологией некроза и структурно-функциональными особенностями органа, в котором он развивается. Различают следующие виды некроза: коагуляционный, казеоз-ный, колликвационный, жировой, инфаркт, гангрену, секвестр и пролежень.
Коагуляционный некроз развивается при низкой активности гидролитических процессов, высоком содержании белков и низком содержании жидкости в тканях. Примерами могут служить вос-ковидный, или ценкеровский, некроз мышц при брюшном и сыпном тифе; творожистый некроз при туберкулезе, сифилисе, проказе и лимфогранулематозе; фибриноидный некроз при аллергических и аутоиммунных заболеваниях.
Казеозный (творожистый) некроз - разновидность коагуляционного некроза, получил название за сходство по консистенции, цвету и виду с творогом. При химическом анализе
в некротических тканях (помимо большого количества пре-ципитированного белка) обнаруживают и липи-ды. Некрозу подвержены гранулемы - скопления клеток моноцитарного происхождения. Патогенез казеозного некроза объясняют действием фактора, выделяющегося клетками гранулемы, - ФНО-α, а также факторов микобактерии.
Колликвационный некроз развивается в тканях, богатых жидкостью с высокой активностью гидролитических ферментов, например в очаге серого размягчения головного мозга. Для очагов репер-фузии в демаркационной зоне инфаркта миокарда также характерно развитие колликвационного некроза, которому предшествует коагуляционный некроз кардиомиоцитов.
Гангрена (от греч. gangrania - пожар) - некроз тканей, соприкасающихся с внешней средой. Погибшие ткани имеют черную окраску в результате образования сульфида железа из железа Hb и сероводорода воздуха. Гангрена может развиваться в различных частях тела, легких, кишечнике, матке. Существуют три разновидности гангрены - сухая, влажная и пролежень.
•Сухая гангрена, при которой ткани мумифицируются, на границе с сохранной живой тканью определяют зону демаркационного воспаления. Встречают в
•Влажная гангрена возникает в тканях при действии гнилостных микроорганизмов. Ткань набухает, становится отечной, издает зловонный запах, демаркационная зона не определяется. Влажную гангрену встречают в легких, кишечнике и матке. У ослабленных корью детей влажная гангрена может развиться на коже щек, промежности, ее называют номой (от греч. nome - водяной рак).
•Пролежень считают разновидностью гангрены трофоневротического генеза. Возникает в местах наибольшего давления у ослабленных больных, страдающих сердечнососудистыми, инфекционными, онкологическими и нервными заболеваниями.
Секвестр - участок мертвой ткани, который не подвергается аутолизу, не замещается соединительной тканью и свободно располагается среди живых тканей. Секвестры обычно вызывают развитие гнойного воспаления и могут удаляться через образующиеся при этом свищевые ходы. Секвестрации чаще подвержена костная ткань, однако секвестры, хотя и редко, обнаруживают и в мягких тканях.
Инфаркт (от лат. infarcire - начинать, набивать) - сосудистый некроз (ишемический). Причины инфаркта - тромбоз, эмболия, длительный спазм артерий и функциональное перенапряжение органа в условиях гипоксии (недостаточности коллатерального кровообращения). Различают инфаркты по форме и цвету. Форма инфаркта зависит от ангиоархитектоники органа и развитости коллатерального кровообращения и может быть клиновидной и неправильной. Клиновидная форма инфаркта характерна
для органов с магистральным типом ветвления сосудов и со слаборазвитыми коллатералями (селезенка, почка, легкое). Неправильную форму инфаркта наблюдают в органах с рассыпным или смешанным типом ветвления артерий (миокард, головной мозг).
По цвету инфаркт может быть белым (селезенка, головной мозг), белым с геморрагическим венчиком (сердце, почки) и красным (геморрагическим). Геморрагический венчик формируется за счет зоны демаркационного воспаления, которая закономерно возникает на границе мертвых и живых тканей. Красный цвет инфаркта обусловлен пропитыванием некротических тканей кровью, как это бывает при инфарктах легкого на фоне хронического венозного полнокровия.
Исходы некроза. Нередко некроз ткани или органа имеет неблагоприятный исход и приводит больного к смерти. Таковы, например, инфаркты миокарда, головного мозга, некроз коркового вещества почек, некроз надпочечников, прогрессирующий некроз печени, панкреонекроз. К неблагоприятным исходам некроза относят также гнойное
Книга рекомендована к покупке и прочтению разделом по патофизиологии сайта https://medicalplanet.su/
расплавление, что может быть причиной прогрессирования гнойного воспаления вплоть до генерализации инфекционного процесса и развития сепсиса.
Благоприятные исходы некроза связаны с процессами отграничения и репарации, начинающимися и распространяющимися из зоны демаркационного воспаления. К ним относят: организацию или рубцевание (замещение некротических масс соединительной тканью), инкапсуляцию [отграничение некротизированного участка соединительнотканной капсулой; при этом некротические массы петрифицируются (пропитываются солями кальция) и оссифицируются (образуется кость)]. На месте колликвационного некроза образуется мезоглиальный рубчик (при небольших размерах некроза) или киста.
РАЗЛИЧИЯ МЕЖДУ НЕКРОЗОМ И АΠОΠТОЗОМ
Некроз и апоптоз - разновидности гибели клеток в живом организме, их различают по распространенности, генетическим, биохимическим, морфологическим и клиническим проявлениям.
Существенное отличие апоптоза от некроза - распространение апоптоза всегда только на отдельные клетки или их группы, в то время как некроз может захватывать территории от части клетки до целого органа.
Апоптоз возникает в клетках при определенных генетических перестройках, которые изучены еще недостаточно. При апоптозе усилена экспрессия генов, контролирующих пролиферацию и дифференцировку клеток из группы клеточных
протоонкогенов (c-fos, c-myc, c-bcl-2) и антионкогенов (р53). Активация клеточных онкогенов должна вести к усилению пролиферации клеток, но при одновременной активации антионкогена p53 наступает апоптоз. Описанные взаимоотношения между генами демонстрируют возможность координации процессов пролиферации и гибели клеток, заложенной в их генетическом аппарате. Взаимодействия между генами происходят посредством их белковых продуктов, поэтому в клетке усилен белковый синтез в момент апоптоза.
Ингибирование этого синтеза может предотвращать апоптоз.
Отличия апоптоза от некроза относят в основном к изменениям внутриклеточных структур и наиболее достоверно выявляют с помощью специальных морфологических методов.
Литература
1.Патологическая анатомия. Курс лекций / под ред. В.В. Серова, М.А. Пальцева. - М.,
1998.
2.Серов В.В. Общепатологические подходы к познанию болезни. - М., 1999.
Глава 3. НАРУШЕНИЯ КРОВО- И ЛИМФООБРАЩЕНИЯ
Б.Б. Салтыков, П.Ф. Литвицкий
НАРУШЕНИЯ КРОВООБРАЩЕНИЯ
Выделяют три вида нарушений кровообращения: нарушения проницаемости стенки сосудов (кровотечение, кровоизлияние, плазморрагия), нарушения кровенаполнения (артериальное малокровие и полнокровие, венозное полнокровие) и нарушения реологических свойств крови (стаз, тромбоз, эмболия).
НАРУШЕНИЯ ПРОНИЦАЕМОСТИ СТЕНОК СОСУДОВ
Нарушения проницаемости сосудистой стенки приводит к кровотечению или к плазморрагии.
Кровотечения
Кровотечение (геморрагия, от греч. haima, кровь и rhein, течь; МКБ-10: R58. Кровотечение, не классифицируемое в других рамках, Т14.5. Травма кровеносного(ых) сосуда(ов) неуточненной области тела) - выход крови за пределы сосудистого русла или сердца в окружающую среду (наружное кровотечение) или в полости тела, просвет полого органа (внутреннее кровотечение). Примерами наружного кровотечения являются метроррагия (маточное), мелена (кишечное), а внутреннего - гемоперикард, гемоторакс или гемоперитонеум (в полость перикарда, плевры или брюшной полости соответственно). По источнику кровотечения подразделяют на артериальные, венозные, арте-риально-венозные (смешанные), капиллярные, паренхиматозные (капиллярные из паренхиматозных органов) и сердечные.
Частным видом кровотечения является кровоизлияние, при котором кровь накапливается в тканях экстраваскулярно. Различают 4 его разновидности [1, 3]:
•гематома - кровоизлияние с нарушением целостности тканей и образованием полости (рис. 3.1, см. цв. вклейку);
•геморрагическое пропитывание (имбиби-ция) - кровоизлияние с сохранением ткани;
•кровоподтек - плоскостное кровоизлияние в коже, подкожной клетчатке, слизистых оболочках;
•петехии - точечные кровоизлияния в коже, слизистых, серозных оболочках и внутренних органах.
Исход кровоизлияний может быть благоприятным (рассасывание излившейся крови, организа-
ция, инкапсуляция, образование «ржавой» кисты, как правило, в головном мозге, где цвет обусловлен образованием гемосидерина) и неблагоприятным (нагноение при присоединении инфекции).
Механизм развития кровотечений и кровоизлияний.
•Разрыв (haemorrhagia per rhexin) возникает вследствие травм неизмененного сосуда или некроза (разрыв сердца при инфаркте миокарда), воспаления (сифилитический мезаортит с разрывом стенки аорты), аневризмы пораженной сосудистой стенки.
•Разъедание (haemorrhagia per diabrosin), или аррозивное кровотечение, развивается при разрушении сосудистой стенки воспалением (чаще гнойным), злокачественной опухолью, некрозом (казеозный некроз в кровоточащей туберкулезной каверне), воздействии химических веществ (желудочный сок может вызвать кровотечение из язвы желудка), прорастании ворсинами хориона сосудов маточной трубы при внематочной беременности.
•Диапедез (haemorrhagia per diapedesin, от греч. dia - через, pedao - скачу)
характеризуется выходом крови за счет повышения сосудистой проницаемости, как правило, сохранных сосудов микроциркуляторного русла при тяжелой гипоксии, интоксикации, инфекции, различных коагулопатиях, геморрагических диатезах. Сравнительно часто диапедезные кровоизлияния развиваются при гипертоническом кризе, системных васкулитах, лейкозах, гемофилии, уремии.
Значение кровотечения обусловлено его видом, выраженностью и продолжительностью. Так, разрыв сердца при инфаркте миокарда с формированием гемоперикарда быстро приводит к смерти больного, хотя общее количество излившейся крови составляет обычно
Книга рекомендована к покупке и прочтению разделом по патофизиологии сайта https://medicalplanet.su/
