
- •Тема 1: Предмет органической химии. Классификация,номенклатура, изомерия органических соединений
- •Предметорганическойхимии.Характеристика органических соединений
- •Изомерии;
- •Органическая химия имеет исключительно важное познавательное инароднохозяйственное значение.
- •2. Теорияхимическогостроенияорганических
- •Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение вещества определяет его свойства.
- •Формулы(способыизображенияорганическихсоединений)
- •Классификацияорганическихсоединений
- •Изомерияорганическихсоединений
- •Структурнаяизомерия
- •Пространственнаяизомерия
- •Геометрическаяизомерия
- •Оптическаяизомерия
- •Конформации(поворотнаяизомерия)
- •Тема 2: Электронное строение и реакционная способностьорганических соединений
- •Типысвязейвмолекулахорганическихсоединений
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Строение.
- •Номенклатураалканов
- •ПорядокпостроенияназванияразветвленногоалканапоИюпак
- •Изомерия
- •Структурнаяизомерия
- •Оптическаяизомерия
- •Радикалыилизаместители.
- •2.Химическиесвойства.Общиепредставленияомеханизмецепныхрадикальных реакций замещения в алканах (на примере реакциигалогенирования).
- •Сульфированиеисульфокисление:
- •Дегидрирования
- •В.Изомеризация
- •3.Способыполученияипрактическоеиспользование
- •2Гидpиpованиенепpедельныхуглеводоpодов:
- •Изсолейкарбоновыхкислот:
- •Разложениекарбидовметаллов(метанидов)водой:
- •Тема4:Циклоалканы
- •Общаяхарактеристика
- •Номенклатура
- •Изомерияциклоалканов
- •Структурнаяизомеpия
- •Пространственнаяизомерия
- •Химическиесвойства
- •Получениециклоалканов
- •Применение
- •Тема5:Алкены
- •1.Общаяхарактеристика:строение,номенклатура,изомерия
- •Строение
- •Номенклатура
- •Физическиесвойства
- •2.Химическиесвойства
- •Механизмыреакции присоединения калкенам:
- •Креакциямэлектрофильногоприсоединения аЕотносятся:
- •ОбъяснениеправилаМарковникова
- •Современная формулировка правила Марковникова:электрофильное присоединение к двойной связи идет черезобразование наиболее устойчивого карбокатиона.
- •Реакциягидратации
- •Реакцииокисленияалкенов:
- •Эпоксидирование (реакция н.А. Прилежаева, 1909г)эпоксидирование (по Прилежаеву)
- •Окислениевприсутствиисолейпалладия:
- •Реакцииозонирования.
- •Гидроборированиеалкеновииспользованиевсинтезеспиртов.
- •Реакцииполимеризации
- •Аллильноехлорированиеалкенов,механизм
- •Реакцииизомеризацииалкенов
- •Способыполученияипрактическоеиспользование
- •Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходитпреимущественно от наименее гидрогенизированного атома углерода.
- •Применениеалкенов
- •Тема6:Алкадиены
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Общаяформулаалкадиенов:СnН2n-2.Классификация диенов:
- •Кумулированные:
- •Номенклатура
- •Международная
- •Электронноестроение Делокализованныеπ-связи.Сопряжение
- •Химическиесвойства
- •Химические свойства диенов с сопряженными двойнымисвязями
- •Гидрирование
- •Галогенирование
- •Гидрогалогенирование,гидратации
- •Полимеризациясопряженныхдиенов
- •3.Получениеалкадиенов
- •4.Каучуки.Синтетическиекаучуки
- •Тема7:Алкины
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Номенклатураалкинов
- •Изомерияалкинов
- •Физическиесвойства
- •Химическиесвойства
- •Гидрирование
- •Б)Гомогенноегидрирование
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация(реакцияКучерова)
- •Присоединениекарбоновыхкислот:
- •Реакциинуклеофильногоприсоединения
- •РеакцияФаворского
- •Реакцииполимеризации
- •Образованиеалкинидов
- •Этот метод дает возможность переходить от простых ацетиленовых углеводородов к более сложным.
- •Б)Реакцииокислительногорасщепления
- •Получениеалкинов
- •Применение
- •Тема8:Ароматическиеуглеводороды(арены)
- •Критерииароматичности.ПравилоХюккеля.
- •Теплотагидрированиябензола
- •Ароматическойявляется:
- •Небензоидные ароматические системы: циклопропенилий- и тропилий-катионы, циклопентадиенильный анион, азулен.
- •Арены. Общая характеристика: строение, номенклатура,изомерия
- •Одноядерныеарены:
- •Многоядерныеарены:
- •Гомологическийряд:
- •4.Химическиесвойствааренов
- •Электрофильноезамещениевбензольномкольце.
- •Наиболеетипичнаясхемареакцииароматическогоэлектрофильного замещения:
- •Свободнорадикальноегалогенированиебензола иалкилбензолов
- •АцилированиепоФриделю–Крафтсу
- •Реакция сульфированияпроисходит при нагревании под действием «дымящей» серной кислоты (олеум) с образованием ароматических сульфокислот:
- •Ориентацияприсоединениявмонозамещенныхбензолах
- •6.Конденсированныеароматическиеуглеводороды
- •В общем и целом, полиядерные конденсированные соединенияболее реакционноспособны (и менее ароматичны), чем бензолы.
- •Ориентация замещения в монозамещенных нафталине иантрацене
- •Антрацен
- •Антрахинон
- •Фенантрен
- •Конденсированные полиядерные соединения (нафталин, антрацен, фенантрен) получают, главным образом, при коксованииуглей.
- •Тема9: Галогенпроизводныеуглеводородов
- •1.Общаяхарактеристика
- •Наполярностьсвязивлияют:
- •Химическиесвойства
- •Реакциинуклеофильногозамещения,механизмыSn1 иSn2
- •Протеканиюреакциипомономолекулярномумеханизму(sn1)спо-собствуют:
- •Таким образом, протеканию замещения по бимолекулярномумеханизму (sn2) благоприятствуют:
- •Соединениясповышеннойипониженнойподвижностьюатома галогена
- •Реакционнаяспособностьвинил-иарилгалогенидов
- •Которое гласит, что придегидрогалогенировании алкилгалогенидовводород отщепляется от соседнего наименее гидрогенизированного атома углерода:
- •Получение литий- и магнийорганических соединений и ихиспользование в органическом синтезе
- •3.Способыполучениягалогенпроизводныхуглеводородов
- •4.Биологическое действие галогенпроизводных, их применение в народном хозяйстве
- •Тема 10:Спирты (одноатомные, многоатомные), тиолы, простыеэфиры
- •1 Общая характеристика одноатомных спиртов: строение, номенклатура, изомерия. Физические свойства спиртов, роль водородной связи
- •В зависимости от того, с каким атомом углерода(первичным,вторичным или третичным)связана гидроксогруппа, различаютспирты:
- •Номенклатураспиртов
- •2.Химическиесвойстваодноатомныхспиртов
- •Реакциизамещенияатомаводороданаметалл(кислотныесвойства)
- •Алкоголяты металлов обладают сильными основными инуклеофильными свойствами в отличие от спиртов (см. Ниже).
- •Реакция этерификации - образование сложных эфиров.(нуклеофильные свойства спиртов)
- •Реакциисгалогенидами фосфораисеры
- •Отдельныепредставители.
- •3.Многоатомныеспирты:особенностихимическихсвойств
- •4.Промышленныеилабораторныеметодыполученияспиртов
- •Щелочнойгидролизгалогеноуглеводородов:
- •Гликоли получают окислением алкенов щелочным или нейтральным раствором kMnO4(реакция Вагнера):
- •В технике глицерин получают гидролизом (омылением) природных жиров и масел:
- •Химическиесвойства
- •Простыеэфиры
- •Номенклатураиизомерия
- •Способыполучения
- •Тема11: Фенолы
- •1 Общая характеристика фенолов: классификация, строение, номенклатура, изомерия, физические свойства
- •2.Химическиесвойствафенолов
- •Образованиепростыхалкилариловыхэфиров
- •Образованиепростыхдиариловыхэфиров
- •Образованиесложныхэфиров-реакцияацилирования
- •Галогенирование
- •Нитрование
- •Сульфирование
- •Ацилирование
- •Реакциясформальдегидом
- •Карбоксилирование.РеакцияКольбе
- •Восстановление
- •Окисление
- •Качественнаяреакциянафенолы
- •3Промышленныеилабораторныеметодыполученияфенолов.
- •Гидролизводных растворовароматическихдиазосоединений
- •Тема12: Карбонильныесоединения
- •Общая характеристика карбонильных соединений: строение, классификация, номенклатура, изомерия, электронное строение
- •Изомерияальдегидов:
- •Енолизация,кето-енольнаятаутомерия.
- •Физическиесвойства
- •Электронноестроениекарбонильнойгруппы
- •Химическиесвойствакарбонильныхсоединений
- •Присоединениециановодородной (синильной)кислотыHcn:
- •Присоединениегидросульфитанатрия
- •Присоединениеаммиакаи егопроизводных
- •Первичныхспиртов:
- •Окислительно-восстановительныереакции
- •Альдольнаяикротоноваяконденсации.
- •3 Способыполученияипрактическоеиспользование карбонильных соединений
- •Окислениеспиртов
- •Гидратацияалкинов(реакцияКучерова)
- •Восстановлениехлорангидридовкарбоновыхкислот–реакцияРозенмунда
- •Почислукарбоксильных группкислотыподразделяютсяна:
- •Номенклатура
- •Изомерия
- •Спирта(сложныйэфир), аммиака (амид),
- •Химические свойства одноосновных карбоновых кислот и ихпроизводных
- •Способы получения и практическое использование одноосновных карбоновых кислот
- •5Сложныеэфирыкарбоновыхкислот.Жиры
- •Тема 14: Непредельные,ароматическиеидикарбоновыекарбоновыекислоты
- •Непредельныекарбоновыекислоты
- •Отдельныепредставителинепредельныходноосновныхкислот
- •Высшиенепредельныекислоты
- •A.Двухосновныекарбоновыекислоты
- •Свойствадвухосновныхкислот
- •Способыполучениядвухосновныхкислот
- •Ненасыщенныедикарбоновыекислоты
- •3Ароматическиекарбоновыекислоты
- •Химическиесвойства
- •Важнейшиепредставители
- •Ароматическиедикарбоновыекислоты
- •Важнейшиепредставители
- •Тема15: Амины.Азо-идиазосоединения
- •Амины.Общаяхарактеристика
- •2Химическиесвойстваалифатическихаминов
- •Особенностихимическихсвойствароматическихаминов
- •4Способыполученияаминов
- •Отдельныепредставителиалифатическихаминов
- •Диазосоединения
- •Реакции,идущиесвыделениемазота
- •Образованиегалогенопроизводных(реакцияЗандмейера).
- •Замещение диазогруппы, катализируемое солями одновалентноймеди (реакция Зандмейера)
- •Реакции,идущиебезвыделенияазота
- •В основе всех азокрасителей лежитядроазобензола,ипоэтому все азокрасители можно рассматривать как производныеазобензола.
- •Тема16:Гидрокси-,оксо-иаминокислоты.Пептидыибелки
- •Гидроксикислоты
- •Основныепредставители:
- •Оптическаяизомерияоксикислот
- •Еслигидроксилрасположенсправа–этоD-конфигурацияилиD-ряд. Если гидроксил расположен слева – этоL- конфигурация илиL-ряд.
- •Молочнаякислота
- •Яблочнаякислота
- •2(R),3(s)бутандиол-2,3
- •Винныекислоты
- •Особенностихимическихсвойств
- •Поведениеоксикислотпринагревании
- •2Оксокислоты(альдегидо-икетокислоты)
- •Общаяформула:
- •Особенностихимическихсвойств
- •Специфическиесвойства
- •Глиоксиловаякислота
- •Ацетоуксуснаякислота
- •Аминокислоты.Пептидыибелки
- •Оптическаяизомерияаминокислот
- •Методыполученияаминокислот
- •Особенностихимическихсвойств
- •Реакциясформальдегидом
- •Нингидриннаяреакция(качественная)
- •Этерификация
- •Термическоеповедениеаминокислот
- •Номенклатура
- •Примеры:
- •Тема17: Углеводы:моносахариды,дисахариды,полисахариды
- •Углеводы:общаяхарактеристика,классификация
- •Моносахариды(монозы)
- •2.1.Изомериямоносахаридов
- •МетоOдHыпHолучениямоносахаридов
- •Химическиесвойствамоносахаридов
- •Окислениемоносахаридов
- •Восстановлениемоносахаридов
- •Действиещелочейнамоносахариды
- •Реакциициклическихформмоносахаридов
- •Отдельныепредставителимоносахаридов
- •Дисахариды
- •Отдельныепредставителидисахаридов
- •Высшиеполисахариды
- •Тема18:Гетероциклическиесоединения
- •Пятичленныегетероциклы:фуран,тиофен,пиррол,ихстроениеНоменклатура
- •Реакционнаяспособность
- •Методыполучения
- •Гидрированиепиррола
- •Сульфирование
- •Галоидирование
- •Синтезпиридина
- •Строениепиридина.
- •IiРеакцииэлектрофильногоамещения
- •Реакциинуклеофильногозамещения
- •Восстановление(гидрирование)
- •Реакциинуклеофильногозамещения,snAr Биологическиактивныепроизводныехинолина
Дисахариды
Дисахаридыилибиозы– сложныесахараобщейформулыС12Н22О11.
Они относятся к группе олигосахаридов, которые при гидролизе образуют два моносахарида:
С12Н22О11 + Н2О С6Н12О6 + С6Н12О6
сахароза моносахариды
К важнейшим дисахаридам относятся сахароза, лактоза ицеллобиоза.
По химической структуре дисахариды представляют собойгликозиды,образованныеврезультатеотщеплениямолекулыводыотдвухмоносахаридовзасчетгидроксиловпоодномуоткаждогоизних. Приэтомодинизгидроксиловявляетсягликозидным.Похимическим свойствамбиозыделятнаневосстанавливающиеивосстанавливающиесахара. Если отщепление молекулы воды произошло за счет гликозидныхгидроксилов обеих молекул моносахаридов, то образуется невосстанавливающий дисахарид, называемый гликозидогликозидом.Такие дисахариды существуют только в циклических конфигурациях
и не могут изомеризоваться в цепные карбонильные формы и, следовательно, не обладают восстановительными свойствами. В частности, водные растворы гликозидгликозидных дисахаридов не дают реакцию "серебряного зеркала", не обесцвечивают реактив Фелинга, не подвергаются мутаротации. Типичным примером невосстанавливающего дисахарида является сахароза.
 Если
отщепление воды произошло за счет
гликозидного гидроксила только одного
из моносахаридов и негликозидного
гидроксила другого моносахарида, то
образуется восстанавливающий дисахарид,
в котором один из циклов сохраняет
гликозидный гидроксил, способный в
водных растворах изомеризоваться,
превращаясь в цепную карбонильную
форму. К восстанавливающим дисахаридам
относятся мальтоза, лактоза и целлобиоза,
водные растворы которых дают реакцию
"серебряного зеркала" и восстанавливают
раствор Фелинга.
Если
отщепление воды произошло за счет
гликозидного гидроксила только одного
из моносахаридов и негликозидного
гидроксила другого моносахарида, то
образуется восстанавливающий дисахарид,
в котором один из циклов сохраняет
гликозидный гидроксил, способный в
водных растворах изомеризоваться,
превращаясь в цепную карбонильную
форму. К восстанавливающим дисахаридам
относятся мальтоза, лактоза и целлобиоза,
водные растворы которых дают реакцию
"серебряного зеркала" и восстанавливают
раствор Фелинга.
Отдельныепредставителидисахаридов
Сахароза.По структуре сахароза представляет собой гликозидогликозид, образованныйвследствиедегидратациизасчетгликозидныхгидроксилов
 -D-глюкопиранозы(-D-глюкозы)и-D-фруктофуранозы(-D-
фруктозы).Изэтогоследуетхимическиеназваниесахарозыкак-D-
глюкопиранозил--D-фруктофуранозид.Вмолекулесахарозыкольцо
пиранозы и кольцо фуранозы между собой
соединены атомом кислорода одного из
общих гликозидных гидроксилов. Вследствие
этого в молекуле сахарозы отсутствует
возможность изомеризации хотя бы одного
кольца в
карбонильнуюформуи,какрезультат,-отсутствиевосстановительных
свойств.Гидролизсахарозыидетсразрывомкислородногомостика.В
результате получаются равномолекулярные
количества-D-глюкозы
и- D-фруктозы. Такая
смесь называетсяинвертным сахаром.
-D-глюкопиранозы(-D-глюкозы)и-D-фруктофуранозы(-D-
фруктозы).Изэтогоследуетхимическиеназваниесахарозыкак-D-
глюкопиранозил--D-фруктофуранозид.Вмолекулесахарозыкольцо
пиранозы и кольцо фуранозы между собой
соединены атомом кислорода одного из
общих гликозидных гидроксилов. Вследствие
этого в молекуле сахарозы отсутствует
возможность изомеризации хотя бы одного
кольца в
карбонильнуюформуи,какрезультат,-отсутствиевосстановительных
свойств.Гидролизсахарозыидетсразрывомкислородногомостика.В
результате получаются равномолекулярные
количества-D-глюкозы
и- D-фруктозы. Такая
смесь называетсяинвертным сахаром.
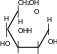 CHO
CHO
 CH2OH
CH2OH
O
HH H
H C OH
 HO C H
HO C H
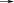
OH H
HO
H OHO
+H2O


-H2O
H OH
H C OH
 H C OH
H C OH
1 CH2OH
 CH2OH
CH2OH
HOH2C
H
O
 H HO
H HO
OH H
CH2OH
HOH2C
H
O
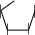 H HO
H HO
OH H
OH
 CH2OH
CH2OH
2
C=O
HO C H
H C OH
H C OHCH2OH
сахароза,[]D=+66,50
1--D-глюкоза,[]D=+52,50
2--D-фруктоза,[]D=-920
Сахароза или тростниковый (свекловичный) сахар – бесцветное кристаллическое вещество. Т.пл. 1850С, плотность (d) – 1,5879 г/см3. Сахароза хорошо растворяется в спиртах (метаноле, этаноле). При нагревании выше 2000С она разлагается (карамелизуется), что используется в кондитерском производстве.
Сахароза – оптически активное правовращающее вещество. Однако при гидролизе (инверсии) образующиеся растворы инвертного сахара вращаютплоскостьполяризациисветавлево.[]D=(-92,00)–(+52,50)=
-39,50, поскольку в смеси содержится сильно вращающая влево-D- фруктоза.Инвертныйсахар(искусственныймед)используетсяв кондитерскомпроизводстве,т.к.онпрепятствуеткристаллизации сахарозы,варений,джемов,сиропов,задерживаетчерствениехлеба. Инвертныйсахарлучшерастворим,чемсахарозаислащесахарав1,2раза.
Сахароза является важнейшим питательным продуктом, но чрезмерное употребление очищенного сахара является причиной некоторых заболеваний (например, сахарный диабет). Традиционным источником получения сахарозы является сахарный тростник (14-25% сахарозы) и сахарная свекла (15-20%сахарозы). В нашей стране основным источником сахара является сахарная свекла, производство которой превышало 100 млн. тонн в год. Две три мировой продукции сахара производится из сахарного тростника.
Мальтоза.Тривиальное название мальтозы происходит от латинскогоmaltum –солод, получаемый при неполном гидролизе крахмала, из которого мальтозу получают в производстве. Это восстанавливающий дисахарид, водные растворы которого дают реакцию "серебряного зеркала" и восстанавливают реактив Фелинга, образуя мальтобионовую кислоту. Для мальтозы характерны и другие реакции по альдегиднойгруппе.
По химической структуре мальтоза 4-О-(-D-глюкопиранозил)--D- глюкопираноза,т.е.глюкозидо-глюкоза.Вмолекулемальтозыимеется одингликозидныйгидроксил,поэтомуонаподвергаетсямутаротациии существует в- и-формах, а в растворах– в циклических и альдегидных таутомерныхформах,находящихсямеждусобойвдинамическомравновесии.
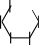 CH2OH
CH2OH
H
OHH
OHH
CH2OH
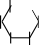 H OH
H OH
+ H
OHH
-H2O
![]() +H2O
+H2O
CH2OH
H
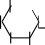
 OH
OH
 H
H
OHH O
HO OHHO OH
 H OH H OH
H OH H OH
HO
H OH 1 H OH
 CH2OH
CH2OH
H OH
 [O]
[O]
CH2OH
H OH
CH2OH
OH
H
 H
H
HOOHH O
H HO
H
OHH
H
O OHH
COOH
H OH
H OH
H OH H OH
3
 CH2OH
CH2OH
OOH
CH2OH
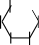 H O
H O
-H2O
CH2OH
O
CH2OH
OOH
![]() HH + H OH HH HH
HH + H OH HH HH
HOOHHH
HOOHHH
+ H2O OHHO
HHO
OHHH
H OH
H OH
H OH
2
H OH
 1–-формамальтозы;
2–-формамальтозы;
1–-формамальтозы;
2–-формамальтозы;
3–мальтобионоваякислота.
Мальтоза хорошо растворяется в воде и кристаллизуется из нее с молекулойводыС12Н22О11Н2О(т.пл.1020С).Мальтоза–правовращающий сахар, []D= + 1120. Сладость мальтозы составляет 0,6 сладости сахарозы. Мальтоза распространена в растительных и животных организмах. Применяют мальтозу (солодовый сахар) в пищевой промышленности в видемальтозной патоки.
Лактоза.Лактоза или молочный сахар (от латинскогоlactum– молоко) содержится в свободном виде в молоке млекопитающих (в коровьем молоке 4-5% лактозы). При гидролизе лактозы образуются равномолекулярные количества-D-глюкопиранозыи-D- галактопиранозы. Лактоза относится к восстанавливающим дисахаридам. Приееокисленииполучаетсялактобионоваякислота.Похимической структурелактозаявляется4-О-(-D-галактопиранозил)--D- глюкопираноза,вкоторойгликозидныйгидроксилпринадлежитостатку
-D-глюкозы.Лактозеприсущамутаротацияионасуществуетв-и- формах.Врастворахлактозасуществуетвциклическойиальдегидной
таутомерных формах, находящихся в динамическом равновесии.
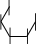 CH2OH
CH2OH
CH2OH
CH2OH
HO HOOH
OHH +
H HOHOHH
-H2O
![]()
HOHO


 OHH
OHH
H H HO
H OH H
OH +H2O H H
OH H OH
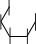
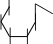
 H OH
H OH
 CH2OHHOHO
CH2OHHOHO
OHH
CH2OH
C
 OH HOH
OH HOH
OHH
CH2OH
 HO O
HO O
[O] H
CH2OH
H
OHO H

H H H
OHH
H H
OHH
COOH
H OH
H OH
H OH
H OH
лактобионоваякислота
 Лактоза
находится преимущественно в-
форме, хорошо растворяется в воде, из
которой кристаллизуется в виде
моногидрата С12Н22О11Н2О,
плавящегося при температуре 2020С.
Она оптически активна []D=
+ 52,60. Сладость лактозы не велика,
составляет 0,16 сладости сахарозы.
Производят лактозу из молочной сыворотки,
используют в пищевой промышленности
(продукты питания для грудных детей) и
для изготовления фармацевтических
препаратов.
Лактоза
находится преимущественно в-
форме, хорошо растворяется в воде, из
которой кристаллизуется в виде
моногидрата С12Н22О11Н2О,
плавящегося при температуре 2020С.
Она оптически активна []D=
+ 52,60. Сладость лактозы не велика,
составляет 0,16 сладости сахарозы.
Производят лактозу из молочной сыворотки,
используют в пищевой промышленности
(продукты питания для грудных детей) и
для изготовления фармацевтических
препаратов.
Целлобиоза.Целлобиоза при гидролизе дает два моля-D-глюкозы.По химическомустроениюцеллобиозапредставляет4-О-(-D- глюкопиранозил)--D-глюкопиранозу,водномизглюкопиранозныхколецкоторойсохранилсягликозидныйгидроксил,способный таутомеризоваться в карбонильную форму. Поэтому целлобиоза является восстанавливающимдисахаридом,которыйприокисленииобразует целлобионовую кислоту. В водных растворах целлобиоза существует в- и-формах,находящихсяв динамическом равновесиискарбонильнойформой.
 CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
H OOH
H HOOH
-H2O H O
H OOH
HOHH
HO H
+ OHHHO H

 +H2OHO
+H2OHO
H
OHH O
H
HOHH

 H
H

 H OH
H OH
H OH
H OH 1
H OH

 CH2OH
CH2OH
CH2OH
CH2OH
H HO
H O H OH
![]()
![]() OHH O
OHH O
HO H
C [O]
 H HO
H HO
H
OHH O
H
HOHH
COOH
H OH
H OH
H OH
H OH
целлобиоза целлобионовая(карбонильная форма) кислота
1 –целлобиоза
Кристаллическая целлобиоза (т.пл.2250С) имеет-форму, хорошо растворяется в воде, вращает плоскость поляризованного света вправо, []D= + 24,40, не сладкая на вкус. Целлобиозу получают гидролизом целлюлозы, для которой она является строительным фрагментом.
Трегалоза.Трегалоза или грибной сахар (микоза) находится во многих грибах. Трегалоза содержится и в других растительных и животных организмах. Известно несколько изомеров трегалозы, из которых в природе встречается только,-изомер. При гидролизе трегалозы образуется-D-глюкоза.Трегалозаневосстанавливающийдисахарид,в которомдваглюкопиранозныхкольцасоединеныкислородныммостиком, образовавшимсявследствиеотщеплениямолекулыводыотдвух гликозидныхгидроксилов.Поэтомупоструктуретрегалозуназывают1- О-(-D-глюкопиранозил)--D-глюкопиранозид (глюкозидо-глюкозид).
CH2OH

 H OH
H OH
H H
 OH H
OH H
H OH
трегалоза
HOH2C OH
O
OH
,-трегалоза хорошо растворяется в воде, из которой кристаллизуется в видедигидратовС12Н22О112Н2О(т.пл.970С);безводнаяплавитсяпри
2050С, оптически активна, []D= + 1780.,-трегалозу получают из пекарских дрожжей.
