
- •Тема 1: Предмет органической химии. Классификация,номенклатура, изомерия органических соединений
- •Предметорганическойхимии.Характеристика органических соединений
- •Изомерии;
- •Органическая химия имеет исключительно важное познавательное инароднохозяйственное значение.
- •2. Теорияхимическогостроенияорганических
- •Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение вещества определяет его свойства.
- •Формулы(способыизображенияорганическихсоединений)
- •Классификацияорганическихсоединений
- •Изомерияорганическихсоединений
- •Структурнаяизомерия
- •Пространственнаяизомерия
- •Геометрическаяизомерия
- •Оптическаяизомерия
- •Конформации(поворотнаяизомерия)
- •Тема 2: Электронное строение и реакционная способностьорганических соединений
- •Типысвязейвмолекулахорганическихсоединений
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Строение.
- •Номенклатураалканов
- •ПорядокпостроенияназванияразветвленногоалканапоИюпак
- •Изомерия
- •Структурнаяизомерия
- •Оптическаяизомерия
- •Радикалыилизаместители.
- •2.Химическиесвойства.Общиепредставленияомеханизмецепныхрадикальных реакций замещения в алканах (на примере реакциигалогенирования).
- •Сульфированиеисульфокисление:
- •Дегидрирования
- •В.Изомеризация
- •3.Способыполученияипрактическоеиспользование
- •2Гидpиpованиенепpедельныхуглеводоpодов:
- •Изсолейкарбоновыхкислот:
- •Разложениекарбидовметаллов(метанидов)водой:
- •Тема4:Циклоалканы
- •Общаяхарактеристика
- •Номенклатура
- •Изомерияциклоалканов
- •Структурнаяизомеpия
- •Пространственнаяизомерия
- •Химическиесвойства
- •Получениециклоалканов
- •Применение
- •Тема5:Алкены
- •1.Общаяхарактеристика:строение,номенклатура,изомерия
- •Строение
- •Номенклатура
- •Физическиесвойства
- •2.Химическиесвойства
- •Механизмыреакции присоединения калкенам:
- •Креакциямэлектрофильногоприсоединения аЕотносятся:
- •ОбъяснениеправилаМарковникова
- •Современная формулировка правила Марковникова:электрофильное присоединение к двойной связи идет черезобразование наиболее устойчивого карбокатиона.
- •Реакциягидратации
- •Реакцииокисленияалкенов:
- •Эпоксидирование (реакция н.А. Прилежаева, 1909г)эпоксидирование (по Прилежаеву)
- •Окислениевприсутствиисолейпалладия:
- •Реакцииозонирования.
- •Гидроборированиеалкеновииспользованиевсинтезеспиртов.
- •Реакцииполимеризации
- •Аллильноехлорированиеалкенов,механизм
- •Реакцииизомеризацииалкенов
- •Способыполученияипрактическоеиспользование
- •Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходитпреимущественно от наименее гидрогенизированного атома углерода.
- •Применениеалкенов
- •Тема6:Алкадиены
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Общаяформулаалкадиенов:СnН2n-2.Классификация диенов:
- •Кумулированные:
- •Номенклатура
- •Международная
- •Электронноестроение Делокализованныеπ-связи.Сопряжение
- •Химическиесвойства
- •Химические свойства диенов с сопряженными двойнымисвязями
- •Гидрирование
- •Галогенирование
- •Гидрогалогенирование,гидратации
- •Полимеризациясопряженныхдиенов
- •3.Получениеалкадиенов
- •4.Каучуки.Синтетическиекаучуки
- •Тема7:Алкины
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Номенклатураалкинов
- •Изомерияалкинов
- •Физическиесвойства
- •Химическиесвойства
- •Гидрирование
- •Б)Гомогенноегидрирование
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация(реакцияКучерова)
- •Присоединениекарбоновыхкислот:
- •Реакциинуклеофильногоприсоединения
- •РеакцияФаворского
- •Реакцииполимеризации
- •Образованиеалкинидов
- •Этот метод дает возможность переходить от простых ацетиленовых углеводородов к более сложным.
- •Б)Реакцииокислительногорасщепления
- •Получениеалкинов
- •Применение
- •Тема8:Ароматическиеуглеводороды(арены)
- •Критерииароматичности.ПравилоХюккеля.
- •Теплотагидрированиябензола
- •Ароматическойявляется:
- •Небензоидные ароматические системы: циклопропенилий- и тропилий-катионы, циклопентадиенильный анион, азулен.
- •Арены. Общая характеристика: строение, номенклатура,изомерия
- •Одноядерныеарены:
- •Многоядерныеарены:
- •Гомологическийряд:
- •4.Химическиесвойствааренов
- •Электрофильноезамещениевбензольномкольце.
- •Наиболеетипичнаясхемареакцииароматическогоэлектрофильного замещения:
- •Свободнорадикальноегалогенированиебензола иалкилбензолов
- •АцилированиепоФриделю–Крафтсу
- •Реакция сульфированияпроисходит при нагревании под действием «дымящей» серной кислоты (олеум) с образованием ароматических сульфокислот:
- •Ориентацияприсоединениявмонозамещенныхбензолах
- •6.Конденсированныеароматическиеуглеводороды
- •В общем и целом, полиядерные конденсированные соединенияболее реакционноспособны (и менее ароматичны), чем бензолы.
- •Ориентация замещения в монозамещенных нафталине иантрацене
- •Антрацен
- •Антрахинон
- •Фенантрен
- •Конденсированные полиядерные соединения (нафталин, антрацен, фенантрен) получают, главным образом, при коксованииуглей.
- •Тема9: Галогенпроизводныеуглеводородов
- •1.Общаяхарактеристика
- •Наполярностьсвязивлияют:
- •Химическиесвойства
- •Реакциинуклеофильногозамещения,механизмыSn1 иSn2
- •Протеканиюреакциипомономолекулярномумеханизму(sn1)спо-собствуют:
- •Таким образом, протеканию замещения по бимолекулярномумеханизму (sn2) благоприятствуют:
- •Соединениясповышеннойипониженнойподвижностьюатома галогена
- •Реакционнаяспособностьвинил-иарилгалогенидов
- •Которое гласит, что придегидрогалогенировании алкилгалогенидовводород отщепляется от соседнего наименее гидрогенизированного атома углерода:
- •Получение литий- и магнийорганических соединений и ихиспользование в органическом синтезе
- •3.Способыполучениягалогенпроизводныхуглеводородов
- •4.Биологическое действие галогенпроизводных, их применение в народном хозяйстве
- •Тема 10:Спирты (одноатомные, многоатомные), тиолы, простыеэфиры
- •1 Общая характеристика одноатомных спиртов: строение, номенклатура, изомерия. Физические свойства спиртов, роль водородной связи
- •В зависимости от того, с каким атомом углерода(первичным,вторичным или третичным)связана гидроксогруппа, различаютспирты:
- •Номенклатураспиртов
- •2.Химическиесвойстваодноатомныхспиртов
- •Реакциизамещенияатомаводороданаметалл(кислотныесвойства)
- •Алкоголяты металлов обладают сильными основными инуклеофильными свойствами в отличие от спиртов (см. Ниже).
- •Реакция этерификации - образование сложных эфиров.(нуклеофильные свойства спиртов)
- •Реакциисгалогенидами фосфораисеры
- •Отдельныепредставители.
- •3.Многоатомныеспирты:особенностихимическихсвойств
- •4.Промышленныеилабораторныеметодыполученияспиртов
- •Щелочнойгидролизгалогеноуглеводородов:
- •Гликоли получают окислением алкенов щелочным или нейтральным раствором kMnO4(реакция Вагнера):
- •В технике глицерин получают гидролизом (омылением) природных жиров и масел:
- •Химическиесвойства
- •Простыеэфиры
- •Номенклатураиизомерия
- •Способыполучения
- •Тема11: Фенолы
- •1 Общая характеристика фенолов: классификация, строение, номенклатура, изомерия, физические свойства
- •2.Химическиесвойствафенолов
- •Образованиепростыхалкилариловыхэфиров
- •Образованиепростыхдиариловыхэфиров
- •Образованиесложныхэфиров-реакцияацилирования
- •Галогенирование
- •Нитрование
- •Сульфирование
- •Ацилирование
- •Реакциясформальдегидом
- •Карбоксилирование.РеакцияКольбе
- •Восстановление
- •Окисление
- •Качественнаяреакциянафенолы
- •3Промышленныеилабораторныеметодыполученияфенолов.
- •Гидролизводных растворовароматическихдиазосоединений
- •Тема12: Карбонильныесоединения
- •Общая характеристика карбонильных соединений: строение, классификация, номенклатура, изомерия, электронное строение
- •Изомерияальдегидов:
- •Енолизация,кето-енольнаятаутомерия.
- •Физическиесвойства
- •Электронноестроениекарбонильнойгруппы
- •Химическиесвойствакарбонильныхсоединений
- •Присоединениециановодородной (синильной)кислотыHcn:
- •Присоединениегидросульфитанатрия
- •Присоединениеаммиакаи егопроизводных
- •Первичныхспиртов:
- •Окислительно-восстановительныереакции
- •Альдольнаяикротоноваяконденсации.
- •3 Способыполученияипрактическоеиспользование карбонильных соединений
- •Окислениеспиртов
- •Гидратацияалкинов(реакцияКучерова)
- •Восстановлениехлорангидридовкарбоновыхкислот–реакцияРозенмунда
- •Почислукарбоксильных группкислотыподразделяютсяна:
- •Номенклатура
- •Изомерия
- •Спирта(сложныйэфир), аммиака (амид),
- •Химические свойства одноосновных карбоновых кислот и ихпроизводных
- •Способы получения и практическое использование одноосновных карбоновых кислот
- •5Сложныеэфирыкарбоновыхкислот.Жиры
- •Тема 14: Непредельные,ароматическиеидикарбоновыекарбоновыекислоты
- •Непредельныекарбоновыекислоты
- •Отдельныепредставителинепредельныходноосновныхкислот
- •Высшиенепредельныекислоты
- •A.Двухосновныекарбоновыекислоты
- •Свойствадвухосновныхкислот
- •Способыполучениядвухосновныхкислот
- •Ненасыщенныедикарбоновыекислоты
- •3Ароматическиекарбоновыекислоты
- •Химическиесвойства
- •Важнейшиепредставители
- •Ароматическиедикарбоновыекислоты
- •Важнейшиепредставители
- •Тема15: Амины.Азо-идиазосоединения
- •Амины.Общаяхарактеристика
- •2Химическиесвойстваалифатическихаминов
- •Особенностихимическихсвойствароматическихаминов
- •4Способыполученияаминов
- •Отдельныепредставителиалифатическихаминов
- •Диазосоединения
- •Реакции,идущиесвыделениемазота
- •Образованиегалогенопроизводных(реакцияЗандмейера).
- •Замещение диазогруппы, катализируемое солями одновалентноймеди (реакция Зандмейера)
- •Реакции,идущиебезвыделенияазота
- •В основе всех азокрасителей лежитядроазобензола,ипоэтому все азокрасители можно рассматривать как производныеазобензола.
- •Тема16:Гидрокси-,оксо-иаминокислоты.Пептидыибелки
- •Гидроксикислоты
- •Основныепредставители:
- •Оптическаяизомерияоксикислот
- •Еслигидроксилрасположенсправа–этоD-конфигурацияилиD-ряд. Если гидроксил расположен слева – этоL- конфигурация илиL-ряд.
- •Молочнаякислота
- •Яблочнаякислота
- •2(R),3(s)бутандиол-2,3
- •Винныекислоты
- •Особенностихимическихсвойств
- •Поведениеоксикислотпринагревании
- •2Оксокислоты(альдегидо-икетокислоты)
- •Общаяформула:
- •Особенностихимическихсвойств
- •Специфическиесвойства
- •Глиоксиловаякислота
- •Ацетоуксуснаякислота
- •Аминокислоты.Пептидыибелки
- •Оптическаяизомерияаминокислот
- •Методыполученияаминокислот
- •Особенностихимическихсвойств
- •Реакциясформальдегидом
- •Нингидриннаяреакция(качественная)
- •Этерификация
- •Термическоеповедениеаминокислот
- •Номенклатура
- •Примеры:
- •Тема17: Углеводы:моносахариды,дисахариды,полисахариды
- •Углеводы:общаяхарактеристика,классификация
- •Моносахариды(монозы)
- •2.1.Изомериямоносахаридов
- •МетоOдHыпHолучениямоносахаридов
- •Химическиесвойствамоносахаридов
- •Окислениемоносахаридов
- •Восстановлениемоносахаридов
- •Действиещелочейнамоносахариды
- •Реакциициклическихформмоносахаридов
- •Отдельныепредставителимоносахаридов
- •Дисахариды
- •Отдельныепредставителидисахаридов
- •Высшиеполисахариды
- •Тема18:Гетероциклическиесоединения
- •Пятичленныегетероциклы:фуран,тиофен,пиррол,ихстроениеНоменклатура
- •Реакционнаяспособность
- •Методыполучения
- •Гидрированиепиррола
- •Сульфирование
- •Галоидирование
- •Синтезпиридина
- •Строениепиридина.
- •IiРеакцииэлектрофильногоамещения
- •Реакциинуклеофильногозамещения
- •Восстановление(гидрирование)
- •Реакциинуклеофильногозамещения,snAr Биологическиактивныепроизводныехинолина
Реакциизамещенияатомаводороданаметалл(кислотныесвойства)
Одноатомные спиртыреагируютс активными металлами(Na, K, Mg, Al и др), образуя соли -алкоголяты (алкоксиды):
2R–OH +2Na→2RO–Na++H2
2C2H5OH + 2K →2C2H5O–K++H2
3(СH3)2CHOH+Al→((CH3)2CHO)3Al+1,5H2
изопропилаталюминия
 Названия
алкоголятов производятся из названий
соответствующих спиртов. Однако спирты
реагируют с натрием идругими
щелочными металлами не так бурно, как
вода, причём по мере увеличения числа
углеродных атомов в углеводородных
радикалах спиртов, реакция протекает
менее интенсивно.Высшие
спиртыреагируютс
натриемтолькопри
нагревании.В
этой реакцииспирты
проявляют свойства кислот,
хотяпрактически
они представляют собой нейтральные
вещества:
не показывают ни кислой, ни щелочной
реакции на лакмус, не проводят электрический
ток.
Названия
алкоголятов производятся из названий
соответствующих спиртов. Однако спирты
реагируют с натрием идругими
щелочными металлами не так бурно, как
вода, причём по мере увеличения числа
углеродных атомов в углеводородных
радикалах спиртов, реакция протекает
менее интенсивно.Высшие
спиртыреагируютс
натриемтолькопри
нагревании.В
этой реакцииспирты
проявляют свойства кислот,
хотяпрактически
они представляют собой нейтральные
вещества:
не показывают ни кислой, ни щелочной
реакции на лакмус, не проводят электрический
ток.
Если в радикале любого спирта есть атом галогена или любойдругой электроноакцепторный заместитель, то кислотные свойства спиртов усиливаются, так как атом галогена или заместитель оттягиваетна себя электронную плотность (-I-эффект):
(СF3)3-C-ОН
Данный спирт способен вытеснять угольную кислоту из её солей, то есть кислотные свойства резко возрастают.
Алкоголяты– твёрдые вещества, обычно хорошорастворимыев соответствующем спирте.
Алкоголяты под действием воды полностью гидролизуются свыделением спирта и гидроксида металла:
C2H5OК+H2O → C2H5OH +КOH
Алкоголяты металлов обладают сильными основными инуклеофильными свойствами в отличие от спиртов (см. Ниже).
Спирты – слабые нуклеофилы. Для увеличения нуклеофильности их превращают в алкоголяты, которые способны взаимодействовать с галогенпроизводными с образованиемпростых эфиров:
R-Hal+R/O-Na+=R-OR/+NaHal
![]() Однако
алкоголят-ионы не только сильные
нуклеофилы, но и сильные основания.Поэтому
их взаимодействие с алкилгалогенидами
может привести как к замещению, так и к
элиминированию в зависимости от
температуры и структуры алкилгалогенида
и алкоголята. Например,для
получения метилизопропилового эфира
необходимо использовать метилиодид и
изопропилат-анион, а не изопропилиодид
и метилат-анион, так как в последнем
случае будет доминировать реакция
отщепления:
Однако
алкоголят-ионы не только сильные
нуклеофилы, но и сильные основания.Поэтому
их взаимодействие с алкилгалогенидами
может привести как к замещению, так и к
элиминированию в зависимости от
температуры и структуры алкилгалогенида
и алкоголята. Например,для
получения метилизопропилового эфира
необходимо использовать метилиодид и
изопропилат-анион, а не изопропилиодид
и метилат-анион, так как в последнем
случае будет доминировать реакция
отщепления:
Реакция этерификации - образование сложных эфиров.(нуклеофильные свойства спиртов)
Спирты вступают в реакции с минеральными и органическимикислотами, образуясложные эфиры, причёматом водорода отщепляется от гидроксогруппы спирта.
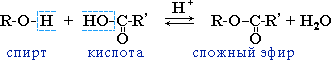 Спирты
взаимодействуют с минеральными и
органическими кислотами с образованием
сложных эфиров и воды:
Спирты
взаимодействуют с минеральными и
органическими кислотами с образованием
сложных эфиров и воды:
С2Н5ОН +HOSO3H
0o
 С2Н5ОSO3H +H2O
С2Н5ОSO3H +H2O
этилсульфат, серноэтиловый
эфир
О НSO O
СНОН +СН_С
2 4 СНО_С_CH
+ HO
2 5 3 25 3 2
ОН уксусноэтиловый эфир,
этилацетат
Механизм реакции этерификации. Образование сложных эфиров при взаимодействии карбоновых кислот со спиртами (этерификация) происходит в условиях кислотного катализа как реакциянуклеофильногозамещения.ПриэтомвмолекулекарбоновойкислотыRCOOHзамещается гидроксильная группа -ОН на группу -OR' от молекулы спирта R'OH (вприведенном ниже примере R'=C2H5). То, что гидроксил отщепляется именно от молекулы кислоты доказанос помощьюметодамеченыхатомов.Еслимолекулаисходногоспирта содержитизотопкислорода18O, то этот "меченый атом" оказывается в молекуле сложного эфира.
Реакциявключаетнесколькообратимыхстадий.
Стадия I. Активация карбоновой кислоты под действиемкатализатора – сильной кислоты (например, конц. H2SO4), превращающейнейтральную молекулу в карбокатион.
СтадияII(лимитирующая).Нуклеофильноеприсоединениеспиртаккарбокатиону.
Стадия III. Миграция протона H+ и формирование хорошейуходящей группы H2O.
 СтадияIV.Отщепление
воды и катализатора (H+) от
неустойчивого продукта присоединения
с образованием cложного эфира.
СтадияIV.Отщепление
воды и катализатора (H+) от
неустойчивого продукта присоединения
с образованием cложного эфира.
Данный процесс классифицируют как реакциюприсоединения-отщепления, т.к. сначала образуются продукты нуклеофильного присоединения (стадия II), которые затем вследствие неустойчивости отщепляют "хорошую уходящую группу" (воду).
Процесс этерификации катализируется как кислотами, так и основаниями. Механизмкислотного катализазаключается в протонировании кислорода карбоксильной группы, что приводит к увеличению электронного дефицита на атоме углерода карбоксильной группы и ускорению атаки молекулой спирта – нуклеофильным реагентом.
R_С
О
ОН
ОН
+Н+ R_С
ОН
ОН
R_С
ОН
ОН
R_С
ОН
-
+О
H
ОН
R R_С ОН
О R H
Н2О,_Н+
R_С
О
О_R
Механизм основного катализа заключается в повышениинуклеофильности молекулы спирта по обменной реакции:
R_О_Н +B R_О +НB

 гдеВ:_ОН , О_R
гдеВ:_ОН , О_R
 ОН
ОН
 О НВ
О НВ


 R_О
R_О
+ С_R R_О С_R

R_О С_R

 НО -:В
НО -:В
ОН
 О
О
-Н2О
ОН

 R_О С_R
R_О С_R
 Реакционная
способность спиртов в реакции этерификации
уменьшается вряду:
Реакционная
способность спиртов в реакции этерификации
уменьшается вряду:
первичные>вторичные>третичные
Такое изменение реакционной способности объясняетсяпространственными факторами.
Спирты легко реагируют с сильными ацилирующими реагентами –хлорангидридами и ангидридами кислот с образованием сложных эфиров:
О
R_С
Cl
+ С2Н5ОН
R_С
ОО_С2Н5
+ HСl
R_С
хлорангидрид сложныйэфир
О
О О
О
R_С
O
+ С2Н5ОН R_С
+ R_С
О_С2Н5 ОН
ангидридкислоты
Реакции дегидратации спиртов.Отщепление воды от молекул спирта(дегидратация спиртов)в зависимости от условий происходит каквнутримолекулярная или межмолекулярная реакция.
Внутримолекулярная дегидратацияспиртов с образованием алкенов идет в присутствииконцентрированной серной кислоты при нагревании выше 140 °С.
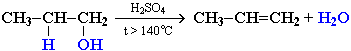
Втехслучаях,когдавозможны2направленияреакции,например:
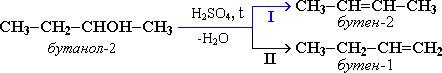
дегидратация идет преимущественно в направлении I, т.е. поправилуЗайцева– с образованием более замещенного алкена(водород отщепляется от менее гидрогенизированного атома углерода).
Межмолекулярная дегидратацияспиртов происходитпри температуре ниже 140 °Сс образованием простых эфиров:
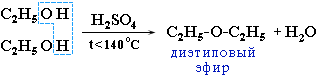
 РеакциипротекающиесразрывомR_OHсвязи
РеакциипротекающиесразрывомR_OHсвязи
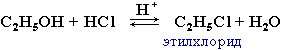 Реакция
с галогеноводородами.
Замещение гидроксила ОН на галоген
происходит в реакции спиртов с
галогеноводородами в присутствиикатализатора
– сильной минеральной кислоты (например,
конц. H2SO4).При
этом спирты проявляютсвойства
слабыхоснований.
Реакция
с галогеноводородами.
Замещение гидроксила ОН на галоген
происходит в реакции спиртов с
галогеноводородами в присутствиикатализатора
– сильной минеральной кислоты (например,
конц. H2SO4).При
этом спирты проявляютсвойства
слабыхоснований.
Механизмреакции-нуклеофильноезамещениеSN.
Нуклеофил–хлорид-анионCl:––замещаетгруппуHO–.Данная реакция является одним из способов получения галогеноуглеводородов.
Реакционнаяспособностьгалогеноводородоввреакцияхсоспиртами уменьшается в ряду:
HJ>HBr>HCl
