
- •Тема 1: Предмет органической химии. Классификация,номенклатура, изомерия органических соединений
- •Предметорганическойхимии.Характеристика органических соединений
- •Изомерии;
- •Органическая химия имеет исключительно важное познавательное инароднохозяйственное значение.
- •2. Теорияхимическогостроенияорганических
- •Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение вещества определяет его свойства.
- •Формулы(способыизображенияорганическихсоединений)
- •Классификацияорганическихсоединений
- •Изомерияорганическихсоединений
- •Структурнаяизомерия
- •Пространственнаяизомерия
- •Геометрическаяизомерия
- •Оптическаяизомерия
- •Конформации(поворотнаяизомерия)
- •Тема 2: Электронное строение и реакционная способностьорганических соединений
- •Типысвязейвмолекулахорганическихсоединений
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Строение.
- •Номенклатураалканов
- •ПорядокпостроенияназванияразветвленногоалканапоИюпак
- •Изомерия
- •Структурнаяизомерия
- •Оптическаяизомерия
- •Радикалыилизаместители.
- •2.Химическиесвойства.Общиепредставленияомеханизмецепныхрадикальных реакций замещения в алканах (на примере реакциигалогенирования).
- •Сульфированиеисульфокисление:
- •Дегидрирования
- •В.Изомеризация
- •3.Способыполученияипрактическоеиспользование
- •2Гидpиpованиенепpедельныхуглеводоpодов:
- •Изсолейкарбоновыхкислот:
- •Разложениекарбидовметаллов(метанидов)водой:
- •Тема4:Циклоалканы
- •Общаяхарактеристика
- •Номенклатура
- •Изомерияциклоалканов
- •Структурнаяизомеpия
- •Пространственнаяизомерия
- •Химическиесвойства
- •Получениециклоалканов
- •Применение
- •Тема5:Алкены
- •1.Общаяхарактеристика:строение,номенклатура,изомерия
- •Строение
- •Номенклатура
- •Физическиесвойства
- •2.Химическиесвойства
- •Механизмыреакции присоединения калкенам:
- •Креакциямэлектрофильногоприсоединения аЕотносятся:
- •ОбъяснениеправилаМарковникова
- •Современная формулировка правила Марковникова:электрофильное присоединение к двойной связи идет черезобразование наиболее устойчивого карбокатиона.
- •Реакциягидратации
- •Реакцииокисленияалкенов:
- •Эпоксидирование (реакция н.А. Прилежаева, 1909г)эпоксидирование (по Прилежаеву)
- •Окислениевприсутствиисолейпалладия:
- •Реакцииозонирования.
- •Гидроборированиеалкеновииспользованиевсинтезеспиртов.
- •Реакцииполимеризации
- •Аллильноехлорированиеалкенов,механизм
- •Реакцииизомеризацииалкенов
- •Способыполученияипрактическоеиспользование
- •Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходитпреимущественно от наименее гидрогенизированного атома углерода.
- •Применениеалкенов
- •Тема6:Алкадиены
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Общаяформулаалкадиенов:СnН2n-2.Классификация диенов:
- •Кумулированные:
- •Номенклатура
- •Международная
- •Электронноестроение Делокализованныеπ-связи.Сопряжение
- •Химическиесвойства
- •Химические свойства диенов с сопряженными двойнымисвязями
- •Гидрирование
- •Галогенирование
- •Гидрогалогенирование,гидратации
- •Полимеризациясопряженныхдиенов
- •3.Получениеалкадиенов
- •4.Каучуки.Синтетическиекаучуки
- •Тема7:Алкины
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Номенклатураалкинов
- •Изомерияалкинов
- •Физическиесвойства
- •Химическиесвойства
- •Гидрирование
- •Б)Гомогенноегидрирование
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация(реакцияКучерова)
- •Присоединениекарбоновыхкислот:
- •Реакциинуклеофильногоприсоединения
- •РеакцияФаворского
- •Реакцииполимеризации
- •Образованиеалкинидов
- •Этот метод дает возможность переходить от простых ацетиленовых углеводородов к более сложным.
- •Б)Реакцииокислительногорасщепления
- •Получениеалкинов
- •Применение
- •Тема8:Ароматическиеуглеводороды(арены)
- •Критерииароматичности.ПравилоХюккеля.
- •Теплотагидрированиябензола
- •Ароматическойявляется:
- •Небензоидные ароматические системы: циклопропенилий- и тропилий-катионы, циклопентадиенильный анион, азулен.
- •Арены. Общая характеристика: строение, номенклатура,изомерия
- •Одноядерныеарены:
- •Многоядерныеарены:
- •Гомологическийряд:
- •4.Химическиесвойствааренов
- •Электрофильноезамещениевбензольномкольце.
- •Наиболеетипичнаясхемареакцииароматическогоэлектрофильного замещения:
- •Свободнорадикальноегалогенированиебензола иалкилбензолов
- •АцилированиепоФриделю–Крафтсу
- •Реакция сульфированияпроисходит при нагревании под действием «дымящей» серной кислоты (олеум) с образованием ароматических сульфокислот:
- •Ориентацияприсоединениявмонозамещенныхбензолах
- •6.Конденсированныеароматическиеуглеводороды
- •В общем и целом, полиядерные конденсированные соединенияболее реакционноспособны (и менее ароматичны), чем бензолы.
- •Ориентация замещения в монозамещенных нафталине иантрацене
- •Антрацен
- •Антрахинон
- •Фенантрен
- •Конденсированные полиядерные соединения (нафталин, антрацен, фенантрен) получают, главным образом, при коксованииуглей.
- •Тема9: Галогенпроизводныеуглеводородов
- •1.Общаяхарактеристика
- •Наполярностьсвязивлияют:
- •Химическиесвойства
- •Реакциинуклеофильногозамещения,механизмыSn1 иSn2
- •Протеканиюреакциипомономолекулярномумеханизму(sn1)спо-собствуют:
- •Таким образом, протеканию замещения по бимолекулярномумеханизму (sn2) благоприятствуют:
- •Соединениясповышеннойипониженнойподвижностьюатома галогена
- •Реакционнаяспособностьвинил-иарилгалогенидов
- •Которое гласит, что придегидрогалогенировании алкилгалогенидовводород отщепляется от соседнего наименее гидрогенизированного атома углерода:
- •Получение литий- и магнийорганических соединений и ихиспользование в органическом синтезе
- •3.Способыполучениягалогенпроизводныхуглеводородов
- •4.Биологическое действие галогенпроизводных, их применение в народном хозяйстве
- •Тема 10:Спирты (одноатомные, многоатомные), тиолы, простыеэфиры
- •1 Общая характеристика одноатомных спиртов: строение, номенклатура, изомерия. Физические свойства спиртов, роль водородной связи
- •В зависимости от того, с каким атомом углерода(первичным,вторичным или третичным)связана гидроксогруппа, различаютспирты:
- •Номенклатураспиртов
- •2.Химическиесвойстваодноатомныхспиртов
- •Реакциизамещенияатомаводороданаметалл(кислотныесвойства)
- •Алкоголяты металлов обладают сильными основными инуклеофильными свойствами в отличие от спиртов (см. Ниже).
- •Реакция этерификации - образование сложных эфиров.(нуклеофильные свойства спиртов)
- •Реакциисгалогенидами фосфораисеры
- •Отдельныепредставители.
- •3.Многоатомныеспирты:особенностихимическихсвойств
- •4.Промышленныеилабораторныеметодыполученияспиртов
- •Щелочнойгидролизгалогеноуглеводородов:
- •Гликоли получают окислением алкенов щелочным или нейтральным раствором kMnO4(реакция Вагнера):
- •В технике глицерин получают гидролизом (омылением) природных жиров и масел:
- •Химическиесвойства
- •Простыеэфиры
- •Номенклатураиизомерия
- •Способыполучения
- •Тема11: Фенолы
- •1 Общая характеристика фенолов: классификация, строение, номенклатура, изомерия, физические свойства
- •2.Химическиесвойствафенолов
- •Образованиепростыхалкилариловыхэфиров
- •Образованиепростыхдиариловыхэфиров
- •Образованиесложныхэфиров-реакцияацилирования
- •Галогенирование
- •Нитрование
- •Сульфирование
- •Ацилирование
- •Реакциясформальдегидом
- •Карбоксилирование.РеакцияКольбе
- •Восстановление
- •Окисление
- •Качественнаяреакциянафенолы
- •3Промышленныеилабораторныеметодыполученияфенолов.
- •Гидролизводных растворовароматическихдиазосоединений
- •Тема12: Карбонильныесоединения
- •Общая характеристика карбонильных соединений: строение, классификация, номенклатура, изомерия, электронное строение
- •Изомерияальдегидов:
- •Енолизация,кето-енольнаятаутомерия.
- •Физическиесвойства
- •Электронноестроениекарбонильнойгруппы
- •Химическиесвойствакарбонильныхсоединений
- •Присоединениециановодородной (синильной)кислотыHcn:
- •Присоединениегидросульфитанатрия
- •Присоединениеаммиакаи егопроизводных
- •Первичныхспиртов:
- •Окислительно-восстановительныереакции
- •Альдольнаяикротоноваяконденсации.
- •3 Способыполученияипрактическоеиспользование карбонильных соединений
- •Окислениеспиртов
- •Гидратацияалкинов(реакцияКучерова)
- •Восстановлениехлорангидридовкарбоновыхкислот–реакцияРозенмунда
- •Почислукарбоксильных группкислотыподразделяютсяна:
- •Номенклатура
- •Изомерия
- •Спирта(сложныйэфир), аммиака (амид),
- •Химические свойства одноосновных карбоновых кислот и ихпроизводных
- •Способы получения и практическое использование одноосновных карбоновых кислот
- •5Сложныеэфирыкарбоновыхкислот.Жиры
- •Тема 14: Непредельные,ароматическиеидикарбоновыекарбоновыекислоты
- •Непредельныекарбоновыекислоты
- •Отдельныепредставителинепредельныходноосновныхкислот
- •Высшиенепредельныекислоты
- •A.Двухосновныекарбоновыекислоты
- •Свойствадвухосновныхкислот
- •Способыполучениядвухосновныхкислот
- •Ненасыщенныедикарбоновыекислоты
- •3Ароматическиекарбоновыекислоты
- •Химическиесвойства
- •Важнейшиепредставители
- •Ароматическиедикарбоновыекислоты
- •Важнейшиепредставители
- •Тема15: Амины.Азо-идиазосоединения
- •Амины.Общаяхарактеристика
- •2Химическиесвойстваалифатическихаминов
- •Особенностихимическихсвойствароматическихаминов
- •4Способыполученияаминов
- •Отдельныепредставителиалифатическихаминов
- •Диазосоединения
- •Реакции,идущиесвыделениемазота
- •Образованиегалогенопроизводных(реакцияЗандмейера).
- •Замещение диазогруппы, катализируемое солями одновалентноймеди (реакция Зандмейера)
- •Реакции,идущиебезвыделенияазота
- •В основе всех азокрасителей лежитядроазобензола,ипоэтому все азокрасители можно рассматривать как производныеазобензола.
- •Тема16:Гидрокси-,оксо-иаминокислоты.Пептидыибелки
- •Гидроксикислоты
- •Основныепредставители:
- •Оптическаяизомерияоксикислот
- •Еслигидроксилрасположенсправа–этоD-конфигурацияилиD-ряд. Если гидроксил расположен слева – этоL- конфигурация илиL-ряд.
- •Молочнаякислота
- •Яблочнаякислота
- •2(R),3(s)бутандиол-2,3
- •Винныекислоты
- •Особенностихимическихсвойств
- •Поведениеоксикислотпринагревании
- •2Оксокислоты(альдегидо-икетокислоты)
- •Общаяформула:
- •Особенностихимическихсвойств
- •Специфическиесвойства
- •Глиоксиловаякислота
- •Ацетоуксуснаякислота
- •Аминокислоты.Пептидыибелки
- •Оптическаяизомерияаминокислот
- •Методыполученияаминокислот
- •Особенностихимическихсвойств
- •Реакциясформальдегидом
- •Нингидриннаяреакция(качественная)
- •Этерификация
- •Термическоеповедениеаминокислот
- •Номенклатура
- •Примеры:
- •Тема17: Углеводы:моносахариды,дисахариды,полисахариды
- •Углеводы:общаяхарактеристика,классификация
- •Моносахариды(монозы)
- •2.1.Изомериямоносахаридов
- •МетоOдHыпHолучениямоносахаридов
- •Химическиесвойствамоносахаридов
- •Окислениемоносахаридов
- •Восстановлениемоносахаридов
- •Действиещелочейнамоносахариды
- •Реакциициклическихформмоносахаридов
- •Отдельныепредставителимоносахаридов
- •Дисахариды
- •Отдельныепредставителидисахаридов
- •Высшиеполисахариды
- •Тема18:Гетероциклическиесоединения
- •Пятичленныегетероциклы:фуран,тиофен,пиррол,ихстроениеНоменклатура
- •Реакционнаяспособность
- •Методыполучения
- •Гидрированиепиррола
- •Сульфирование
- •Галоидирование
- •Синтезпиридина
- •Строениепиридина.
- •IiРеакцииэлектрофильногоамещения
- •Реакциинуклеофильногозамещения
- •Восстановление(гидрирование)
- •Реакциинуклеофильногозамещения,snAr Биологическиактивныепроизводныехинолина
Тема 10:Спирты (одноатомные, многоатомные), тиолы, простыеэфиры
Общаяхарактеристикаодноатомныхспиртов:строение,номенклатура,
изомерия.Физическиесвойства спиртов,рольводороднойсвязи
Химические свойства одноатомных спиртов: кислотно-основные свойства, реакции нуклеофильного замещения с участием спиртов, внутри-имежмолекулярная дегидратация спиртов(образованиеалкенови простых эфиров), окисление первичных и вторичных спиртов
Многоатомныеспирты:особенностихимическихсвойств
 Промышленныеилабораторныеметодыполученияспиртов5.Тиолы
Промышленныеилабораторныеметодыполученияспиртов5.Тиолы
6.Простыеэфиры
1 Общая характеристика одноатомных спиртов: строение, номенклатура, изомерия. Физические свойства спиртов, роль водородной связи
Спиртыклассифицируютпоразличнымструктурнымпризнакам.
Почислугидроксильныхгруппспиртыподразделяютсяна:
одноатомные(однагруппа-ОН);
многоатомные(двеиболеегрупп-ОН).
В зависимости от того, с каким атомом углерода(первичным,вторичным или третичным)связана гидроксогруппа, различаютспирты:
первичныеR–CH2–OH;
вторичныеR2CH–OH;
третичныеR3C–OH.
В многоатомных спиртах различаютпервично-, вторично- и третичноспиртовыегруппы. Например, молекула трехатомного спирта глицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы.
Построению радикалов, связанных с атомом кислорода, спирты подразделяются на:
предельные,илиалканолы(например,СH3CH2–OH);
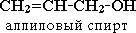 непредельные,илиалкенолы(CH2=CH–CH2–OH);
непредельные,илиалкенолы(CH2=CH–CH2–OH);ароматические(C6H5CH2–OH).
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы исразу же изомеризуются в альдегиды или кетоны. Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O.
Данный процесс подтверждаетсяреакцией Кучерова- присоединениеводыпроисходитвприсутствиикатализаторасолиртути
 (II)
и идет через образование неустойчивого
непредельного спирта, который изомеризуется
в уксусный альдегид (в случае ацетилена):
(II)
и идет через образование неустойчивого
непредельного спирта, который изомеризуется
в уксусный альдегид (в случае ацетилена):
иливкетон(вслучаедругихалкинов):
Предельные одноатомные спиртыимеют общую формулу:СnН2n+1ОН, являются функциональными производными предельных углеводородов и содержат одну функциональную группу –ОН.
Гомологическийрядпредельныходноатомныхспиртов:СН3ОН- метиловый спирт,метанол;
С2Н5ОН– этиловый спирт,этанол;С3Н7ОН–пропиловыйспирт,пропанол;С4Н9ОН- бутиловый спирт,бутанол;С5Н11ОН–амиловый спирт,пентанол;С6Н13ОН– гексиловый спирт,гексанол;С7Н15ОН– гептиловый спирт,гептанол;С8Н17ОН– октиловый спирт,октанол;С9Н19ОН– нониловый спирт,нонанол;С10Н21ОН– дециловый спирт,деканол.
Двухатомные спирты (гликоли)имеют общую формулу:СnН2n(ОН)2, являются производными углеводородов, в которых две гидроксильные группы замещают два атома водорода в углеводородноймолекулы.
Простейшийпредставитель:HOCH2CH2OHэтиленгликоль
Трёхатомные спирты (алкантриолы)содержат три гидроксогруппы при разных атомах углерода, общая формула:СnН2n-1(ОН)3. Простейший представитель: глицерин
Номенклатураспиртов
Широкораспространенытривиальныеназвания: метиловый спирт – древесный спирт;
этиловыйспирт–винныйспирт.
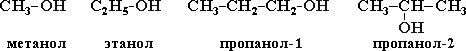 Систематические
названиядаются
по названию углеводорода с добавлением
суффикса-ол
и цифры,
указывающей положение гидроксогруппы
(если это необходимо):
Систематические
названиядаются
по названию углеводорода с добавлением
суффикса-ол
и цифры,
указывающей положение гидроксогруппы
(если это необходимо):
 Нумерация
ведется от ближайшего к ОН-группе конца
цепи. Цифра, отражающая местоположение
ОН-группы, в русском языке обычно ставится
после суффикса "ол". Это разгружает
словесную часть названия от цифр
(например, 2-метилбутанол-1). В англоязычной
литературе цифру ставят перед названием
главной цепи: 2-метил-2-бутанол. Правила
IUPAC разрешают учитывать особенности
национального языка.
Нумерация
ведется от ближайшего к ОН-группе конца
цепи. Цифра, отражающая местоположение
ОН-группы, в русском языке обычно ставится
после суффикса "ол". Это разгружает
словесную часть названия от цифр
(например, 2-метилбутанол-1). В англоязычной
литературе цифру ставят перед названием
главной цепи: 2-метил-2-бутанол. Правила
IUPAC разрешают учитывать особенности
национального языка.
В полифункциональных соединениях при наличии функциональных групп старше гидроксильной, последняя обозначается приставкойокси-илигидрокси-.
Аналогично,названиядаютсядвухатомным и трёхатомным спиртам, за исключением того, что в названиях двухатомных спиртов к названию углеводорода добавляетсясуффикс –диол, а в названиях трёхатомных спиртов к названию углеводорода добавляетсясуффикс –триол.
По другому способу(радикально-функциональная номенклатура)названия спиртов производятот названий алкильных радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт.
Вэтойноменклатуреположениезаместителявалкильнойгруппе обозначается буквами греческого алфавита.
Порациональной номенклатуреза основу выбирается атом углерода, с которым связана гидроксогруппа. Именно этот атом углеродасгидроксогруппойиобозначаетсясловом«карбинол».Названия
 предельных
одноатомных спиртов строятсяиз
названийуглеводородных
радикалов сдобавлением
слова «карбинол»:
предельных
одноатомных спиртов строятсяиз
названийуглеводородных
радикалов сдобавлением
слова «карбинол»:
 Этаноменклатураудобнадлясамыхпростыхспиртов,т.к.вней
легко различаются первичные, вторичные
и третичные спирты.
Этаноменклатураудобнадлясамыхпростыхспиртов,т.к.вней
легко различаются первичные, вторичные
и третичные спирты.
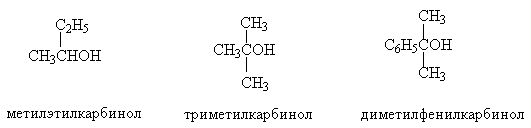
Примеры:
СН3
СН_СН
_ОН
СН_СН_СН_ОН 2 2
3 2
втор.бутиловыйспирт -фенилэтиловыйспирт
метилэтилкарбинол бензилкарбинол
2-бутанол 2-фенилэтанол
3 2 2 2 2
СН_СН_СН=СН СН_СН_СНОН ОН ОН
бутен-2-ол пропан-1,3-диол
Изомерия:
Дляспиртовхарактерныследующиевидыизомерии:
структурнаяизомерия:
углеродногоскелета
 изомерияположенияОН-группы(начинаясС3)
изомерияположенияОН-группы(начинаясС3)
межклассовая
Предельныеодноатомныеспиртыизомерныпростымэфирам,например:
СН3-СН2-СН2-ОН(пропанол-1)изомеренметилэтиловомуэфируСН3-О- С2Н5.Оба эти соединения имеют в своём составе три атома углерода, восемь атомов водорода и один атом кислорода.
пространственнаяизомерия
–оптическая(зеркальная):
бутанол-2СH3CH(OH)СH2CH3, в молекуле которого второй атомуглерода связан с четырьмя различными заместителями, существуетв форме двух зеркальных изомеров. Таким образом, формуле C4H9OH соответствует5изомерных спиртов (4структурныхизомера иодинизних
бутанол-2-ввидедвухзеркальныхизомеров).
–цис-транс-изомерияхарактернадлянепредельныхспиртов.
Физические свойства.Газов в гомологическом ряду нет.Это жидкости. Начиная с С12Н25ОН доС20Н41ОН – маслообразные и с С21Н43ОН—твердыевещества.ТкипСН3ОН=65°С,ТкипС2Н5ОН=78°С,
(С2Н5ОН)=0,8г/см3
Первичные спиртыс разветвлённой цепью обычно имеют более низкие температуры кипения. Длятретичных спиртовхарактерны наиболее высокие температуры плавления. Спирты с количеством атомов углерода 12 и выше –твёрдые вещества.
Всеспиртылегчеводы(плотностьнижеединицы).
Низшие спирты имеют специфический (алкогольный) запах, спирты с С4и С5обладают сладковатым, удушливым запахом, а от С6до С11– неприятным. Высшие спирты запаха не имеют.
Простейшим представителем двухатомных спиртов является этиленгликоль или просто гликоль. Так же как и другие низшие гликоли,этиленгликоль – бесцветная, сиропообразная жидкость, не имеет запаха, обладает сладким вкусом. При приёме внутрь – ядовита. Температура кипения +197оС, температура плавления -13оС.
Представителем трёхатомных спиртов являетсяглицерин – это бесцветная жидкость, без запаха, сладкая на вкус.По внешнему виду напоминает сироп. Очень гигроскопичен, смешивается с водой в любыхсоотношениях.
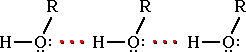 Температура
кипения спиртов выше, чем у соответствующих
предельных углеводородов с тем же
количеством углеродных атомов. Это
свойство объясняется образованиемводородных
связеймежду атомом водорода (содержит
избыточный положительный заряд)
гидроксильной группы одной молекулы и
атомом кислорода (содержит избыточный
отрицательный заряд) гидроксильной
группы другой молекулы:
Температура
кипения спиртов выше, чем у соответствующих
предельных углеводородов с тем же
количеством углеродных атомов. Это
свойство объясняется образованиемводородных
связеймежду атомом водорода (содержит
избыточный положительный заряд)
гидроксильной группы одной молекулы и
атомом кислорода (содержит избыточный
отрицательный заряд) гидроксильной
группы другой молекулы:
АссоциациямолекулROH
При переходе от одноатомных к многоатомным спиртамтемпературы кипения и плавления резко возрастают.
 Образованиеводородныхсвязейсмолекуламиводыспособствует
растворимости гидроксосоединений в
воде:
Образованиеводородныхсвязейсмолекуламиводыспособствует
растворимости гидроксосоединений в
воде:
ГидратациямолекулROH
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксосоединений к одноатомным.Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любыхсоотношениях.
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с не поделенной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникаетводородная связь, которая графически обозначается тремя точками:
Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль) и в основном определяется электростатическим и донорно-акцепторным взаимодействиями.
Евод.св.=25-26кДж/моль; Е (с-н) = 415 кДж/моль;
Е(с-о)=350кДж/моль; Е (о-н) =463 кДж/моль
Водородныесвязивлияютнафизическиеихимическиесвойствавещества.
Этиловый спирт (этанол) СН3-СН-2-ОН– бесцветная жидкость, горит слабосветящимсяпламенем.Этиловыйспирттакжекакметиловый смешивается с водой в любых отношениях.
Спирт, с содержаниемводы 4-5 %называютректификатором, а спирт, содержащий толькодоли процента воды, называютабсолютнымспиртом.
