
- •Тема 1: Предмет органической химии. Классификация,номенклатура, изомерия органических соединений
- •Предметорганическойхимии.Характеристика органических соединений
- •Изомерии;
- •Органическая химия имеет исключительно важное познавательное инароднохозяйственное значение.
- •2. Теорияхимическогостроенияорганических
- •Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение вещества определяет его свойства.
- •Формулы(способыизображенияорганическихсоединений)
- •Классификацияорганическихсоединений
- •Изомерияорганическихсоединений
- •Структурнаяизомерия
- •Пространственнаяизомерия
- •Геометрическаяизомерия
- •Оптическаяизомерия
- •Конформации(поворотнаяизомерия)
- •Тема 2: Электронное строение и реакционная способностьорганических соединений
- •Типысвязейвмолекулахорганическихсоединений
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Тема3:Алканы
- •1.Общая характеристика: строение, номенклатура, изомерия Предельныеуглеводороды(алканы,парафины,насыщенные
- •Строение.
- •Номенклатураалканов
- •ПорядокпостроенияназванияразветвленногоалканапоИюпак
- •Изомерия
- •Структурнаяизомерия
- •Оптическаяизомерия
- •Радикалыилизаместители.
- •2.Химическиесвойства.Общиепредставленияомеханизмецепныхрадикальных реакций замещения в алканах (на примере реакциигалогенирования).
- •Сульфированиеисульфокисление:
- •Дегидрирования
- •В.Изомеризация
- •3.Способыполученияипрактическоеиспользование
- •2Гидpиpованиенепpедельныхуглеводоpодов:
- •Изсолейкарбоновыхкислот:
- •Разложениекарбидовметаллов(метанидов)водой:
- •Тема4:Циклоалканы
- •Общаяхарактеристика
- •Номенклатура
- •Изомерияциклоалканов
- •Структурнаяизомеpия
- •Пространственнаяизомерия
- •Химическиесвойства
- •Получениециклоалканов
- •Применение
- •Тема5:Алкены
- •1.Общаяхарактеристика:строение,номенклатура,изомерия
- •Строение
- •Номенклатура
- •Физическиесвойства
- •2.Химическиесвойства
- •Механизмыреакции присоединения калкенам:
- •Креакциямэлектрофильногоприсоединения аЕотносятся:
- •ОбъяснениеправилаМарковникова
- •Современная формулировка правила Марковникова:электрофильное присоединение к двойной связи идет черезобразование наиболее устойчивого карбокатиона.
- •Реакциягидратации
- •Реакцииокисленияалкенов:
- •Эпоксидирование (реакция н.А. Прилежаева, 1909г)эпоксидирование (по Прилежаеву)
- •Окислениевприсутствиисолейпалладия:
- •Реакцииозонирования.
- •Гидроборированиеалкеновииспользованиевсинтезеспиртов.
- •Реакцииполимеризации
- •Аллильноехлорированиеалкенов,механизм
- •Реакцииизомеризацииалкенов
- •Способыполученияипрактическоеиспользование
- •Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходитпреимущественно от наименее гидрогенизированного атома углерода.
- •Применениеалкенов
- •Тема6:Алкадиены
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Общаяформулаалкадиенов:СnН2n-2.Классификация диенов:
- •Кумулированные:
- •Номенклатура
- •Международная
- •Электронноестроение Делокализованныеπ-связи.Сопряжение
- •Химическиесвойства
- •Химические свойства диенов с сопряженными двойнымисвязями
- •Гидрирование
- •Галогенирование
- •Гидрогалогенирование,гидратации
- •Полимеризациясопряженныхдиенов
- •3.Получениеалкадиенов
- •4.Каучуки.Синтетическиекаучуки
- •Тема7:Алкины
- •Общаяхарактеристика:строение,номенклатура,изомерия
- •Номенклатураалкинов
- •Изомерияалкинов
- •Физическиесвойства
- •Химическиесвойства
- •Гидрирование
- •Б)Гомогенноегидрирование
- •Галогенирование
- •Гидрогалогенирование
- •Гидратация(реакцияКучерова)
- •Присоединениекарбоновыхкислот:
- •Реакциинуклеофильногоприсоединения
- •РеакцияФаворского
- •Реакцииполимеризации
- •Образованиеалкинидов
- •Этот метод дает возможность переходить от простых ацетиленовых углеводородов к более сложным.
- •Б)Реакцииокислительногорасщепления
- •Получениеалкинов
- •Применение
- •Тема8:Ароматическиеуглеводороды(арены)
- •Критерииароматичности.ПравилоХюккеля.
- •Теплотагидрированиябензола
- •Ароматическойявляется:
- •Небензоидные ароматические системы: циклопропенилий- и тропилий-катионы, циклопентадиенильный анион, азулен.
- •Арены. Общая характеристика: строение, номенклатура,изомерия
- •Одноядерныеарены:
- •Многоядерныеарены:
- •Гомологическийряд:
- •4.Химическиесвойствааренов
- •Электрофильноезамещениевбензольномкольце.
- •Наиболеетипичнаясхемареакцииароматическогоэлектрофильного замещения:
- •Свободнорадикальноегалогенированиебензола иалкилбензолов
- •АцилированиепоФриделю–Крафтсу
- •Реакция сульфированияпроисходит при нагревании под действием «дымящей» серной кислоты (олеум) с образованием ароматических сульфокислот:
- •Ориентацияприсоединениявмонозамещенныхбензолах
- •6.Конденсированныеароматическиеуглеводороды
- •В общем и целом, полиядерные конденсированные соединенияболее реакционноспособны (и менее ароматичны), чем бензолы.
- •Ориентация замещения в монозамещенных нафталине иантрацене
- •Антрацен
- •Антрахинон
- •Фенантрен
- •Конденсированные полиядерные соединения (нафталин, антрацен, фенантрен) получают, главным образом, при коксованииуглей.
- •Тема9: Галогенпроизводныеуглеводородов
- •1.Общаяхарактеристика
- •Наполярностьсвязивлияют:
- •Химическиесвойства
- •Реакциинуклеофильногозамещения,механизмыSn1 иSn2
- •Протеканиюреакциипомономолекулярномумеханизму(sn1)спо-собствуют:
- •Таким образом, протеканию замещения по бимолекулярномумеханизму (sn2) благоприятствуют:
- •Соединениясповышеннойипониженнойподвижностьюатома галогена
- •Реакционнаяспособностьвинил-иарилгалогенидов
- •Которое гласит, что придегидрогалогенировании алкилгалогенидовводород отщепляется от соседнего наименее гидрогенизированного атома углерода:
- •Получение литий- и магнийорганических соединений и ихиспользование в органическом синтезе
- •3.Способыполучениягалогенпроизводныхуглеводородов
- •4.Биологическое действие галогенпроизводных, их применение в народном хозяйстве
- •Тема 10:Спирты (одноатомные, многоатомные), тиолы, простыеэфиры
- •1 Общая характеристика одноатомных спиртов: строение, номенклатура, изомерия. Физические свойства спиртов, роль водородной связи
- •В зависимости от того, с каким атомом углерода(первичным,вторичным или третичным)связана гидроксогруппа, различаютспирты:
- •Номенклатураспиртов
- •2.Химическиесвойстваодноатомныхспиртов
- •Реакциизамещенияатомаводороданаметалл(кислотныесвойства)
- •Алкоголяты металлов обладают сильными основными инуклеофильными свойствами в отличие от спиртов (см. Ниже).
- •Реакция этерификации - образование сложных эфиров.(нуклеофильные свойства спиртов)
- •Реакциисгалогенидами фосфораисеры
- •Отдельныепредставители.
- •3.Многоатомныеспирты:особенностихимическихсвойств
- •4.Промышленныеилабораторныеметодыполученияспиртов
- •Щелочнойгидролизгалогеноуглеводородов:
- •Гликоли получают окислением алкенов щелочным или нейтральным раствором kMnO4(реакция Вагнера):
- •В технике глицерин получают гидролизом (омылением) природных жиров и масел:
- •Химическиесвойства
- •Простыеэфиры
- •Номенклатураиизомерия
- •Способыполучения
- •Тема11: Фенолы
- •1 Общая характеристика фенолов: классификация, строение, номенклатура, изомерия, физические свойства
- •2.Химическиесвойствафенолов
- •Образованиепростыхалкилариловыхэфиров
- •Образованиепростыхдиариловыхэфиров
- •Образованиесложныхэфиров-реакцияацилирования
- •Галогенирование
- •Нитрование
- •Сульфирование
- •Ацилирование
- •Реакциясформальдегидом
- •Карбоксилирование.РеакцияКольбе
- •Восстановление
- •Окисление
- •Качественнаяреакциянафенолы
- •3Промышленныеилабораторныеметодыполученияфенолов.
- •Гидролизводных растворовароматическихдиазосоединений
- •Тема12: Карбонильныесоединения
- •Общая характеристика карбонильных соединений: строение, классификация, номенклатура, изомерия, электронное строение
- •Изомерияальдегидов:
- •Енолизация,кето-енольнаятаутомерия.
- •Физическиесвойства
- •Электронноестроениекарбонильнойгруппы
- •Химическиесвойствакарбонильныхсоединений
- •Присоединениециановодородной (синильной)кислотыHcn:
- •Присоединениегидросульфитанатрия
- •Присоединениеаммиакаи егопроизводных
- •Первичныхспиртов:
- •Окислительно-восстановительныереакции
- •Альдольнаяикротоноваяконденсации.
- •3 Способыполученияипрактическоеиспользование карбонильных соединений
- •Окислениеспиртов
- •Гидратацияалкинов(реакцияКучерова)
- •Восстановлениехлорангидридовкарбоновыхкислот–реакцияРозенмунда
- •Почислукарбоксильных группкислотыподразделяютсяна:
- •Номенклатура
- •Изомерия
- •Спирта(сложныйэфир), аммиака (амид),
- •Химические свойства одноосновных карбоновых кислот и ихпроизводных
- •Способы получения и практическое использование одноосновных карбоновых кислот
- •5Сложныеэфирыкарбоновыхкислот.Жиры
- •Тема 14: Непредельные,ароматическиеидикарбоновыекарбоновыекислоты
- •Непредельныекарбоновыекислоты
- •Отдельныепредставителинепредельныходноосновныхкислот
- •Высшиенепредельныекислоты
- •A.Двухосновныекарбоновыекислоты
- •Свойствадвухосновныхкислот
- •Способыполучениядвухосновныхкислот
- •Ненасыщенныедикарбоновыекислоты
- •3Ароматическиекарбоновыекислоты
- •Химическиесвойства
- •Важнейшиепредставители
- •Ароматическиедикарбоновыекислоты
- •Важнейшиепредставители
- •Тема15: Амины.Азо-идиазосоединения
- •Амины.Общаяхарактеристика
- •2Химическиесвойстваалифатическихаминов
- •Особенностихимическихсвойствароматическихаминов
- •4Способыполученияаминов
- •Отдельныепредставителиалифатическихаминов
- •Диазосоединения
- •Реакции,идущиесвыделениемазота
- •Образованиегалогенопроизводных(реакцияЗандмейера).
- •Замещение диазогруппы, катализируемое солями одновалентноймеди (реакция Зандмейера)
- •Реакции,идущиебезвыделенияазота
- •В основе всех азокрасителей лежитядроазобензола,ипоэтому все азокрасители можно рассматривать как производныеазобензола.
- •Тема16:Гидрокси-,оксо-иаминокислоты.Пептидыибелки
- •Гидроксикислоты
- •Основныепредставители:
- •Оптическаяизомерияоксикислот
- •Еслигидроксилрасположенсправа–этоD-конфигурацияилиD-ряд. Если гидроксил расположен слева – этоL- конфигурация илиL-ряд.
- •Молочнаякислота
- •Яблочнаякислота
- •2(R),3(s)бутандиол-2,3
- •Винныекислоты
- •Особенностихимическихсвойств
- •Поведениеоксикислотпринагревании
- •2Оксокислоты(альдегидо-икетокислоты)
- •Общаяформула:
- •Особенностихимическихсвойств
- •Специфическиесвойства
- •Глиоксиловаякислота
- •Ацетоуксуснаякислота
- •Аминокислоты.Пептидыибелки
- •Оптическаяизомерияаминокислот
- •Методыполученияаминокислот
- •Особенностихимическихсвойств
- •Реакциясформальдегидом
- •Нингидриннаяреакция(качественная)
- •Этерификация
- •Термическоеповедениеаминокислот
- •Номенклатура
- •Примеры:
- •Тема17: Углеводы:моносахариды,дисахариды,полисахариды
- •Углеводы:общаяхарактеристика,классификация
- •Моносахариды(монозы)
- •2.1.Изомериямоносахаридов
- •МетоOдHыпHолучениямоносахаридов
- •Химическиесвойствамоносахаридов
- •Окислениемоносахаридов
- •Восстановлениемоносахаридов
- •Действиещелочейнамоносахариды
- •Реакциициклическихформмоносахаридов
- •Отдельныепредставителимоносахаридов
- •Дисахариды
- •Отдельныепредставителидисахаридов
- •Высшиеполисахариды
- •Тема18:Гетероциклическиесоединения
- •Пятичленныегетероциклы:фуран,тиофен,пиррол,ихстроениеНоменклатура
- •Реакционнаяспособность
- •Методыполучения
- •Гидрированиепиррола
- •Сульфирование
- •Галоидирование
- •Синтезпиридина
- •Строениепиридина.
- •IiРеакцииэлектрофильногоамещения
- •Реакциинуклеофильногозамещения
- •Восстановление(гидрирование)
- •Реакциинуклеофильногозамещения,snAr Биологическиактивныепроизводныехинолина
Общаяформулаалкадиенов:СnН2n-2.Классификация диенов:
Свойствадиеновыхуглеводородовопределяетсявпервуюочередь
взаимнымрасположениемдвойныхсвязей:
Кумулированные:
СН2ССН2–пропандиен–двойныесвязирасположенырядом, соединения называютсяаллены;
Сопряжённыеиликонъюгированные:
СН2СНСНСН2–бутадиен-1,3(дивинил)-дведвойныесвязи разделены одной простой;
Изолированныеилинесопряжённые:
СН2СНСН2СН2СН2СНСН2–гептадиен-1,3–дведвойные связи разделены двумя и более простыми –несопряжённыедиены.
Номенклатура
Тривиальная
Частоиспользуюттривиальныеназвания:
-
СН2=С=СН2
пропадиен-1,2 аллен
H2C CH CH CH2
бутадиен-1,3 дивинил;
CH3
H2C C CH CH2
2-метилбутадиен-1,3 изопрен.
Международная
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названияалкадиеновпроизводятотназванийсоответствующихалканов(с тем же числом атомов углерода), в которых последняя буква заменяется окончанием –диен.
Местоположениедвойныхсвязейуказываетсявконценазвания,а заместителей – в начале названия.
Например:
CH3 CH3
H2C C
1 2
CH C
3 4
CH3
5



 2,4-диметилпентадиен-1,3.
2,4-диметилпентадиен-1,3.
Название"дивинил"происходитотназваниярадикала–СН=СН2"винил".
Изомерия
Структурнаяизомерия
 Изомерияположениясопряженныхдвойныхсвязей:
Изомерияположениясопряженныхдвойныхсвязей:
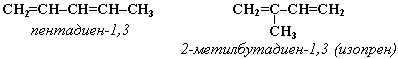 Изомерияуглеродногоскелета:
Изомерияуглеродногоскелета:
Межклассоваяизомериясалкинамиициклоалкенами.
 Например,формулеС4Н6соответствуютследующиесоединения:
Например,формулеС4Н6соответствуютследующиесоединения:
 Пространственнаяизомерия
Пространственнаяизомерия
Диены,имеющие различные заместители при углеродных атомаху двойных связей, подобно алкенам, проявляютцис-транс-изомерию.
Крометого,возможенповоротпо
-связи,разделяющейдвойные
связи, приводящий к поворотным изомерам. Некоторые химические реакции сопряженных диенов идут избирательно только с определенным поворотным изомером.
Физическиесвойства
Некоторые физические свойства диенов представлены в таблице. Общие закономерности, свойственные для гомологических рядов, прослеживаются идля диеновых углеводородов.Например, бутадиен-1,3 - газ, метилбутадиен-1,3 – жидкость.
Наибольшеепрактическоезначениеимеютдивинилилибутадиен-1,3
(легко сжижающийся газ, т.кип = – 4,5
метилбутадиен-1,3(жидкостьст.кип=34 С).
Электронноестроение Делокализованныеπ-связи.Сопряжение
изоCпре)ниили 2-
Ковалентная связь считаетсялокализованной, если ее электронная пара находится в поле двух ядер и связывает толькодваатома.
Делокализованная связь– связь, электронная пара которой рассредоточена междунесколькими(более 2) ядрами атомов (подобие металлическойсвязи).
 Такая
делокализация (рассредоточение)
электронов характерна для сопряженных
π-связей, т.е. кратных связей, чередующихся
с одинарными. Рассредоточение электронов
– энергетически выгодный процесс, т.к.
приводит к снижению энергии молекулы.
Необходимым условием делокализации
π-электронов является перекрываниер-АО
соседнихsp2-
илиsp-атомов,лежащихводнойплоскости.Спомощьюатомно-
орбитальноймоделиможнопоказать,какпроисходитделокализацияπ-
связей в молекуле бутадиена:
Такая
делокализация (рассредоточение)
электронов характерна для сопряженных
π-связей, т.е. кратных связей, чередующихся
с одинарными. Рассредоточение электронов
– энергетически выгодный процесс, т.к.
приводит к снижению энергии молекулы.
Необходимым условием делокализации
π-электронов является перекрываниер-АО
соседнихsp2-
илиsp-атомов,лежащихводнойплоскости.Спомощьюатомно-
орбитальноймоделиможнопоказать,какпроисходитделокализацияπ-
связей в молекуле бутадиена:
Делокализация π-электронов приводит к тому, что в сопряженной системе связи становятся нецелочисленными (дробными), т.е. ни двойными или тройными, ни одинарными. Иначе говоря, связи имеютнецелочисленныйпорядок. Соответственно, длины делокализованных связей имеют промежуточные значения между длинами одинарных и кратных связей.
Таким образом, молекула представляет собой сопряжённую систему, нет “чистых” двойных и одинарных связей, а-электронная плотность распределена по всей молекуле с образованием единой молекулярной орбитали. Это явление получило названиемезомерного эффектаилиэффекта сопряжения, этот эффект ведёт к понижению общей энергии системы и это вещество довольно устойчиво.
Образование единого π-электронного облака, охватывающего 4 атомауглерода:



 С С С
С С С
0,136
нм
0,148
 нм
нм
0,136

 нм
нм
приводит к возможности присоединения реагента по концам этойсистемы,т.е.катомамС1иС4.Поэтомудивинилиизопреннарядус
присоединением 1 моля реагента по одной из двойных связей (1,2- или3,4-) вступают в реакции1,4-присоединения. Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).
