
- •1. Аминокислоты. Классификация(по структуре, по характеру r-групп, заменимые и незаменимые).
- •4.Вторичная структура белка. Альфа- спираль и бета – складчатый слой.
- •5. Третичная структура белка и силы ее стабилизирующие.
- •6. Четвертичная структура белка. Понятия о денатурации и деструкции.
- •7.Кооперативный эффект связывания кислорода гемоглобином.
- •8. Отличия ферментов от неорганических катализаторов.
- •9. Классификация ферментов с примерами реакций на каждый класс.
- •10. Влияние температуры, pH и концентрации фермента на скорость ферментативной реакции.
- •11.Влияние концентрации субстрата на скорость ферментативной реакции. Вывод уравнения Михаэлиса-Ментен.
- •13. Ингибирование ферментов. Неконкурентное ингибирование.
- •14.Аллостерические ферменты.
- •15.Активный центр фермента и его свойства.
- •16. Кофакторы и коферменты. Классификация.
- •17.Молекулярные механизмы ферментативного катализа.
- •18. Способы определения активности фермента. Единицы измерения. Понятие об удельной и молярной активности.
- •19. Изоферменты.
- •20. Моносахариды. Представители и свойства. Функции углеводов.
- •22. Гомо- и гетерополисахариды.
- •23.Липиды. Классификация липидов и их функции.
- •24. Жирные кислоты. Их роль в организме.
- •26. Сфинголипиды. Церамиды. Ганглиозиды
- •27. Неомыляемые липиды. Холестерин и его свойства.
- •28. Воски
- •29. Пути превращения углеводов. Реакции гликолиза и его регуляция.
- •30. Пентозофосфатный путь и его значение.
- •31. Путь Энтнера-Дудорова
- •32. Работа пируватдегидрогеназного комплекса
- •33.Работа цикла трикарбоновых кислот(цтк). Анаплеротические реакции цтк.
- •34.Реакции глюконеогенеза
- •35. Распад и синтез гликогена. Гормональная регуляция.
- •36.Глюкозо-аланиновый и глюкозо-лактатный путь, роль в организме человека.
- •37.Дыхательная цепь митохондрий. Характеристика переносчиков
- •38. Хемиоосмотическая модель п.Митчелла (основные постулаты и доказательства).
- •39.Ингибиторы и разобщители дыхательной цепи митохондрий.
- •40. Витамины, классификация. Антивитамины. Несовместимость витаминов. Особенности водо- и жирорастворимых витаминов.
- •41. Жирорастворимые витамины(a, d, e, k).
- •42. Водорастворимые витамины группы b (b1, b2, в12)
- •43. Фолиевая кислота и пантотеновая кислота
- •44. Витамины с и н.
- •57. Окисление жирных кислот с нечетным числом углеродных атомов.
- •58.Окисление ненасыщенных жирных кислот.
- •59. Реакции синтеза жирных кислот.
- •60. Жирные кислоты. Механизм действия моющих средств.
- •61. Глиоксилатный цикл и его биологическая роль.
- •62. Метаболизм глицерина.
- •63.Пути катаболизма углеродного скелета аминокислот. Пути обмена аминокислот.
- •64. Реакции трансаминирования. Использование трансаминаз в медицине.
- •65.Прямое и непрямое дезаминирование аминокислот.
- •66.Особенности дезаминирования аминокислот в скелетных мышцах
- •67.Метаболизм аммиака.
- •68. Цикл мочевины.
- •69.Химический состав нуклеиновых кислот. Правила Чаргаффа.
- •70.Структурная организация олиго и полинуклеотидов. Характеристика первичной структуры днк.
- •71.Вторичная структура днк. Формы двойной спирали.
- •72.Третичная структура днк.
- •73.Структура и свойства рибосомальных, матричных и транспортных рнк.
- •74. Биосинтез белка. Стадии активации и инициации.
- •75. Биосинтез белка. Стадии элонгации и терминации.
- •76. Ингибиторы биосинтеза белка. Механизм действия дифтерийного токсина.
- •77. Антибиотики-ингибиторы биосинтеза белка.
- •80. Распад липидов в желудочно-кишечном тракте.
- •Переваривание и всасывание
- •Переваривание холестерина
- •Всасывание
1. Аминокислоты. Классификация(по структуре, по характеру r-групп, заменимые и незаменимые).
Классификация аминокислот
Классификация протеиногенных аминокислот по строению радикала:
1) алифатические (глицин, аланин, валин, лейцин, изолейцин, метионин, пролин);
2) ароматические (фенилаланин, тирозин, триптофан);
3) алифатические, содержащие гидроксильную группу (серин, треонин);
4) алифатические, содержащие сульфгидрильную группу (цистеин);
5) основные (лизин, аргинин, гистидин);
6) кислые (аспарагиновая и глутаминовая кислоты);
7) алифатические, содержащие карбоксамидную группу (аспарагин, глутамин).
Аминокислотные остатки в полипептидной цепи имеют сокращенные названия: аланин(ала, А), глицин (гли, G), валин (вал, V), лейцин (лей, L), изолейцин (иле, I), аспарагиноваякислота (асп, D), глутаминовая кислота (глу, Е), серин (сер, S), треонин (тре, Т), цистеин(цис, С), метионин (мет, М), аргинин (арг, R), лизин (лиз, К), гистидин (гис, Н), пролин (про, Р), фенилаланин (фен, F), тирозин (тир, Y), триптофан (три, трп, W), аспарагин (асн,N), глутамин (глн, Q).
Существует несколько специальных классификаций аминокислот, основанных на структуре и химической природе, заменимости, путях метаболизма и т.д.
Классификация аминокислот по полярности радикалов
1. Неполярные аминокислоты (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин). Эти аминокислоты гидрофобны. Имеют незаряженный радикал.
При сближении в пространстве радикалы этих аминокислот обеспечивают гидрофобноевзаимодействие.
2. Полярные, гидрофильные, незаряженные аминокислоты (глицин, треонин, цистеин,тирозин, серин, аспарагин, глутамин). Содержат такие полярные функциональные группы как гидроксильная, сульфгидрильная и амидогруппа. При сближении в пространстве радикалы этих аминокислот образуют водородные связи. Связанные дисульфидной связьюдва остатка цистеина называют цистином.
3. Кислые аминокислоты (отрицательно заряженные аминокислоты) имеют отрицательный заряд при рН 7,0 (аспарагиновая и глутаминовая кислоты)
4. Основные аминокислоты (положительно заряженные аминокислоты) имеют положительный заряд при рН 7,0. (аргинин, гистидин, лизин).
Классификация по биологической (пищевой) ценности
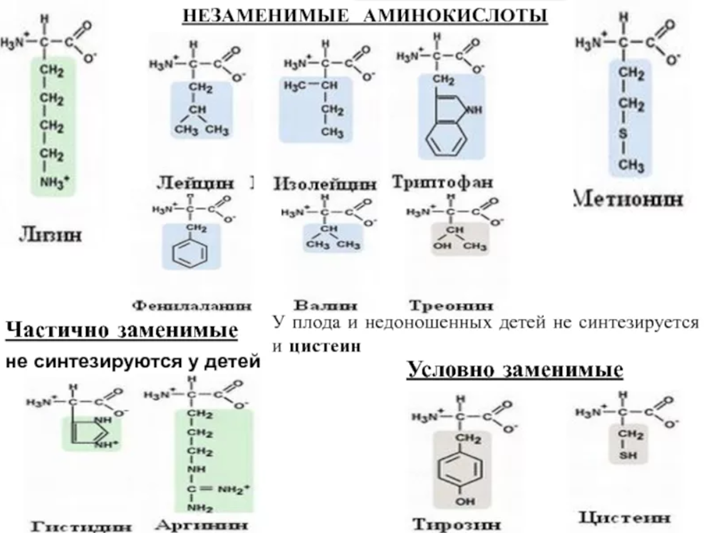
Аминокислоты классифицируют на заменимые и незаменимые (эссенциальные).
1. Незаменимые (эссенциальные) аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они необходимы для обеспечения и поддержания роста: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
2. Заменимые аминокислоты. Организм может синтезировать около 10 аминокислот для обеспечения биологических потребностей, поэтому строгое поступление их с пищей не обязательно (аланин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин, тирозин).
3.3.Классификация аминокислот на основе метаболических превращений
Углеродный скелет аминокислот является предшественником для синтеза глюкозы или гликогена (гликогенные аминокислоты: аланин, аргинин, аспарагиновая кислота, глутаминовая кислота, глицин, цистеин, метионин, пролин, серин, треонин, валин, цистеин), липидов (кетогенная аминокислота: лейцин), глюкозы и липидов (гликогенные и кетогенные аминокислоты - изолейцин, лизин, фенилаланин, триптофан, тирозин).
Кроме 20 стандартных аминокислот, присутствующих в составе белков, существуют аминокислоты, имеющие важное биологическое значение.
1. Производные аминокислот.
Например, коллаген содержит гидроксипролин и гидроксилизин; гистоны - метилированные, фосфорилированные и ацетилированные аминокислоты.
2. Непротеиногенные аминокислоты
Например, орнитин, цитруллин являются промежуточными метаболитами в биосинтезе мочевины.
3. D-аминокислоты. Аминокислоты животных и растений являются L-аминокислотами.
D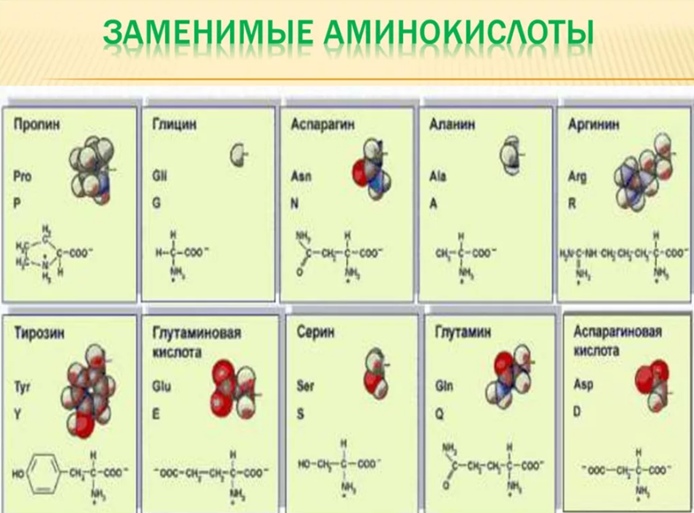 -аминокислоты
обнаружены в антибиотиках или в
бактериальных стенках.
-аминокислоты
обнаружены в антибиотиках или в
бактериальных стенках.
2.Физико-химические свойства АК.
Хим.св-ва. 1) Биуретовая р-я на пептидн связь- в основе спос-сть пептидн связи (СО-NH) с CuSO4 в щел.среде обр-ть окраш комплексы (сине-фиолет). 2) Нингидриновая р-я на а-аминогруппу. Образ-ся сине-фиолет. соединение и прод-в гидролиза АК. 3) Ксантопротеиновая р-я. Идет нитрирование бензольного кольца. 4) Р-я Адамкевича: Триптофан в кисл среде + альдегиды к-т обр-ют продукт конденсации. 5) Р-я Фоля. АК, сод-ие сульфогидрильные группы подв-ся щелочн гидролизу. Физ.с-ва: кристаллич в-ва, лучше раствор в воде, чем в орг р-лях, высок темп плавл. Солеобразные соединения.
Особенности физ и хим св-в аминокислот обусловлены строением - присутствием одноврем противоположн по св-вам функциональн групп: кислотн и основн. α-АК амфотерн электролиты.
3.Первичная структура белка. Характеристика пептидной связи.
Первичная структура - последовательность соединения аминокислот в полипептидной цепи, составляющих молекулу белка. Для опред структ молекулы белка состоящ из неск полипептидн цепей необходимо разъед-ть эти цепи и связи. Нековалентн связи с помощью денатурирующих агентов (р-р мочевины).
Под первичной структурой белка понимают порядок (последовательность) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды являются разными веществами, потому что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка
Пептидная связь представляет собой промежуточную между одинарной и двойной связью, ее длина 1,32А, Вращение вокруг нее невозможно. 2. 6 атомов, расположенных рядом с пептидной связью (2 Сα, О, N, H), находятся в одной плоскости
Название пептидов складывается из названия аминокислот, входящих в состав пептида,причем те аминокислоты, которые реагируют активированной карбоксильной группой,получают в названии окончание «-ил»; так, дипептид, состоящий из глицина и аланина,называется глицил-аланин (сокращенно Gly-Ala);
Концевая аминокислота, в которой карбоксильная группа остается
Наличие в белках разнообразных химических группировок (аминных, карбоксильных,имидазольных, бензольных, гидроксильных, сульфгидрильных, индольных) обусловливает также огромное разнообразие реакционных возможностей белковых молекул.
К свойствам пептидной связи относятся:
Трансположение заместителей (радикалов) аминокислот по отношению к C-N связи.


2. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
3. Наличие кетоформы и енольной формы.
4. Способность к образованию двух водородных связей с другими пептидными группами.
5. Пептидная связь имеет частично характер двойной связи. Ее длина меньше, чем
одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено.
Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
