
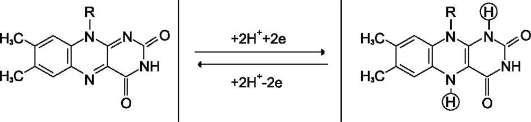
FAD служит акцептором электронов от многих субстратов в реакциях типа:
R-CH2-CH2-R1 + E (FAD) ↔ R-CH=CH-R1 + E (FADH2)
Большинство FAD-зависимых дегидрогеназ — растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинатдегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMNсодержащим ферментам принадлежит NADН-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.
Цепь переноса электронов от NADH и FADH2 на кислород
NADH-дегидрогеназа (NADH-Q-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль простетической группы играет FMN. Единственный субстрат фермента — NADH, с которого 2 электрона и протон переносятся на FMN с образованием FMNH2. Второй протон поглощается из матрикса. Реакция протекает по уравнению:
NADH + H+ + Е (FMN) → NAD+ + Е (FMNH2)
С FMNH2 электроны переносятся затем на ряд железосерных белков (FeS), играющих роль второй простетической группы в молекуле NADH-дегидрогеназы. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в которых атом железа связан с атомом серы остатков цистеина или неорганической серы:
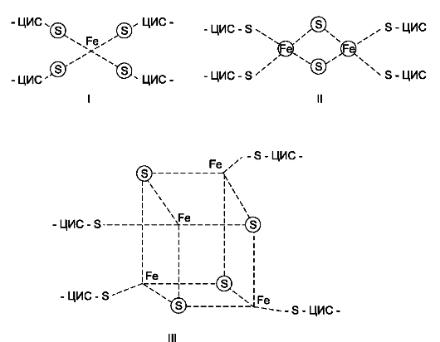
Строение железосерных центров
I — FeS-центр; атом железа связан координационными связями с четырьмя атомами серы, принадлежащими четырём остаткам цистеина в белке. II — Fе2S2- центр; каждый из двух атомов железа связан координационными связями с двумя атомами неорганической серы и двумя остатками цистеина в белке; III — Fе4S4- центр; четыре атома железа связаны с четырьмя атомами серы и четырьмя остатками цистеина в белке. Атомы железа в FeS-центрах могут находиться в окисленном (Fe3+) или восстановленном (Fe2+) состоянии.
NADH-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4. Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри- (Fe3+) состояния. От железосерных центров электроны переносятся на кофермент Q (убихинон):

Структура убихинона (кофермента Q)
n — число изопреноидных звеньев. Убихинон может принимать один электрон и превращаться в семихинон или 2 электрона и полностью восстанавливаться в гидрохинон (убихинол).
Обозначение этого жирорастворимого хинона происходит от первой буквы английского названия хинона (quinone), а название убихинон отражает его широкую распространённость в природе (ubiquitous — вездесущий) — у млекопитающих число изопреноидных звеньев равно 10 и поэтому обозначается как Q10. В процессе переноса электронов с NADH-дегидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинатдегидрогеназы. Убихинон участвует в реакциях типа:
Е (FMNH2) + Q → E (FMN) + QH2
Цитохромы ( гемопротеины) присутствуют во всех типах организмов. В качестве простетической группы содержат гем. Различаются:
-различием боковых цепей в структуре гема;
-различием в структуре полипептидных цепей;
-различием в способе связи полипептидных цепей с гемом.
Взависимости от способности поглощать свет в определённой части спектра все цитохромы делят на группы а, b, с. Структурные особенности разных видов цитохромов определяют различие в их окислительно-восстановительных
потенциалах. В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов.
QH2-дегидрогеназа (коэнзим Q-цитохром с-редуктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QН2-дегидрогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы гема, подобно FеS-центрам, переносят только по одному электрону. Таким образом, от молекулы QН2 2 электрона переносятся на 2 молекулы цитохрома b. В качестве промежуточного продукта в этих реакциях переноса электронов возможно образование свободного радикала семихинона. В цитохромах типа b гем не связан ковалентно с белком, а в цитохромах с1 и с он присоединяется к белку при помощи тиоэфирных связей:
Структура гема цитохромов b, с, с1
Цитохром с — периферический водорастворимый мембранный белок с молекулярной массой 12 500 Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков, и молекулу гема, ковалентно связанную с полипептидом.
Цитохромоксидаза (комплекс IV) состоит из 2 цитохромов типа аа3 , каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют характерную железопорфириновую простетическую группу, называемую гемом А и отличающуюся от гемацитохромов с и с1:
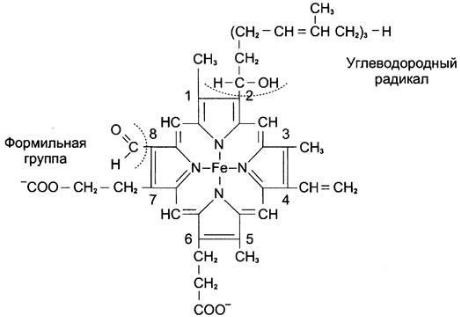
Строение гема А.
Он содержит формильную группу вместо одной из метильных групп и углеводородную цепь вместо одной из винильных групп. Другая особенность комплекса а-а3 — наличие в нём ионов меди, связанных с белковой частью в так называемых СuА-центрах. Перенос электронов комплексом а-а3 включает реакции:
Сu+ ↔ Cu2+ + е‾
Fe2+ ↔ Fe3+ + e‾
Комплекс цитохромов а-а3 непосредственно реагирует с молекулярным кислородом.
Ингибиторы дыхательной цепи
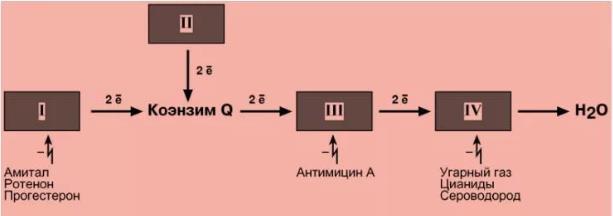
Ингибиторы NADH-дегидрогеназы: ротенон - высокотоксичное вещество, содержащееся в некоторых водорослях и являющееся ядом для рыб; амитал - лекарственный препарат из группы барбитуратов.
Ингибитор QH2-дегидрогеназы: антимицин А, токсичный антибиотик, продуцируемый одним из штаммов Streptomyces.
Ингибиторы цитохромоксидазы: цианид, СО, H2S. Цианид наиболее токсичен для человекаон присоединяется к Fe3+ цитохромоксидазы и блокирует перенос электронов к кислороду.
Окислительное фосфорилирование АДФ
Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается снижением свободной энергии на каждом этапе ЦПЭ, и энергия электронов выделяется порциями.
В дыхательной цепи можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии. Эти этапы способны обеспечить энергией синтез АТФ, так как количество выделяющейся свободной энергии приблизительно равно энергии, необходимой для синтеза АТФ из АДФ и фосфата. Экспериментально было подтверждено, что процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Первый процесс — перенос электронов от восстановленных коферментов NАDH и FАDН2 через ЦПЭ на кислород — экзергонический:
NADH + H+ + 1/2 O2 → NAD+ + H2O + 52 ккал/моль(=220 кДж/моль) (1)
Второй процесс — фосфорилирование АДФ, или синтез АТФ, —
эндергонический:
АДФ + Н3РO4 + 7,3 ккал/моль (30,5 кДж/моль) = АТФ + Н2O. (2)
Синтез АТФ из АДФ и Н3РO4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
Механизм сопряжения окисления и фосфорилирования
Каким же образом осуществляется сопряжение этих двух процессов? Наиболее обоснованный ответ на этот вопрос даёт хемиосмотическая теория Митчелла, предложенная им в 1961 г. Основные положения были подтверждены и разработаны детально совместными усилиями многих исследователей в последующие годы.
Протонный градиент и электрохимический потенциал
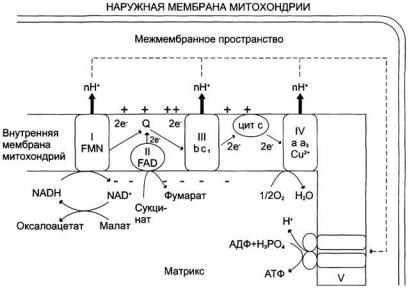
Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ.
Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а pH меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный — на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ∆μН+ — источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ∆μH+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования:
Сопряжение дыхания и синтеза АТФ в митохондриях:
I — NADH-дегидрогеназа; II — сукцинатдегидрогеназа; III — QН2-дегидрогеназа; IV — цитохромоксидаза; V — АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
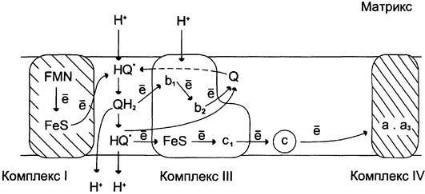
Механизм транспорта протонов через митохондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса III:
Сопряжение переноса электронов через дыхательный комплекс III с транспортом Н+ через мембрану:
Восстановленный убихинон (QН2) взаимодействует с Fе3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (НQ*). Электрон от гема b1 переносится на Fе3+ гема b2. НQ* отдаёт второй электрон на FеS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. ОкисленныйQ диффундирует к внутренней стороне мембраны, где получает электрон от гема b2 и протон из матрикса, превращаясь в НQ*. НQ* получает электрон от комплекса I и протон из матрикса; в мембране образуется QН2, и весь процесс повторяется сначала.
KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q- циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором — цитохром с. Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1, с которого электроны переносятся на цитохром с.
В мембране существует стационарный общий фонд Q/QН2, из которого каждая молекула QН2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФсинтазы.
Строение АТФ-синтазы и синтез АТФ
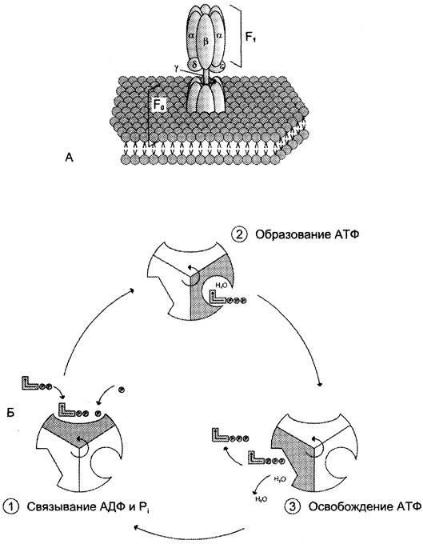
АТФ-синтаза (Н+-АТФ-аза) — интегральный белок внутренней мембраны митохондрий, состоит из 2 белковых комплексов, обозначаемых как F0 и F1:
Строение и механизм действия АТФ-синтазы:
А — F0 и F1 — комплексы АТФ-синтазы. В состав F0 ( не ноль, а О - олигомицинчувствительный)входят полипептидные цепи, которые образуют канал,
пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β («головка»), прикрывающие стержневую часть, которая состоит из 3 субъединиц y, δ и ε. у и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ.
Б — Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 — связывание АДФ и Н3РO4; 2 — образование фосфоангидридной связи АТФ; 3 — освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ.
Коэффициент окислительного фосфорилирования
Окисление молекулы NАDН в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FАD-зависимых дегидрогеназ поступают в ЦПЭ на КоQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ.
Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О.Следовательно, для NАDН Р/О = 3, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
Дыхательный контроль
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется, и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода.
Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем.
Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ
