
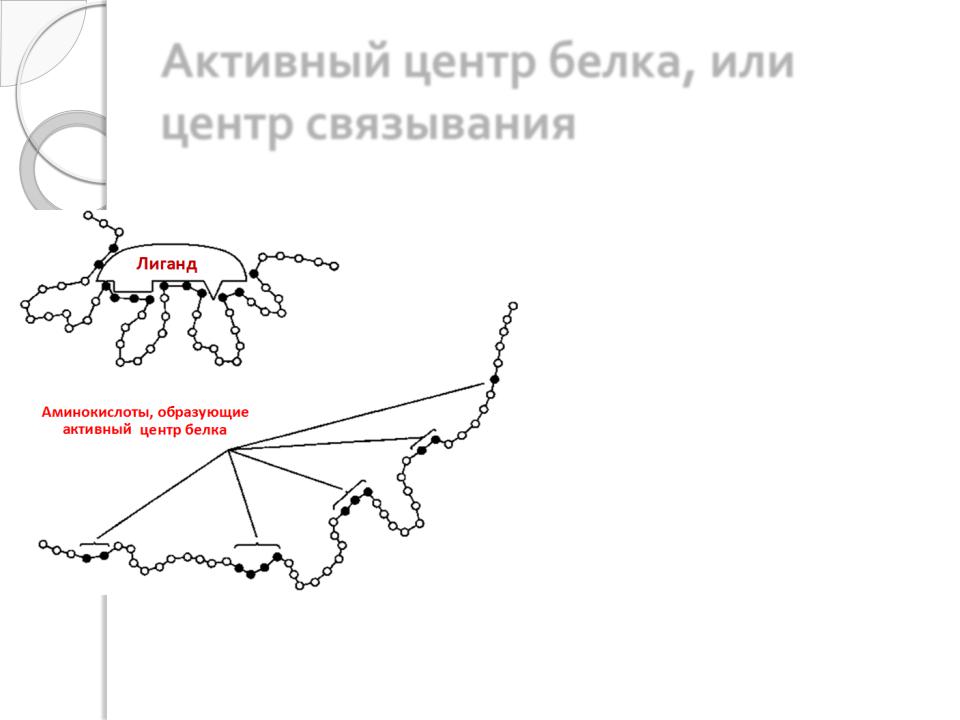
Активный центр белка, или центр связывания
Центр связывания формируется при образовании нативной пространственной (природной, биологически активной) конформации, т.е. третичной структуры (или четвертичной, если она есть). Центр связывания образуется боковыми радикалами аминокислот, причѐм эти аминокислоты в первичной структуре могут находиться на значительном расстоянии друг от друга и только в третичной оказываются сближены.
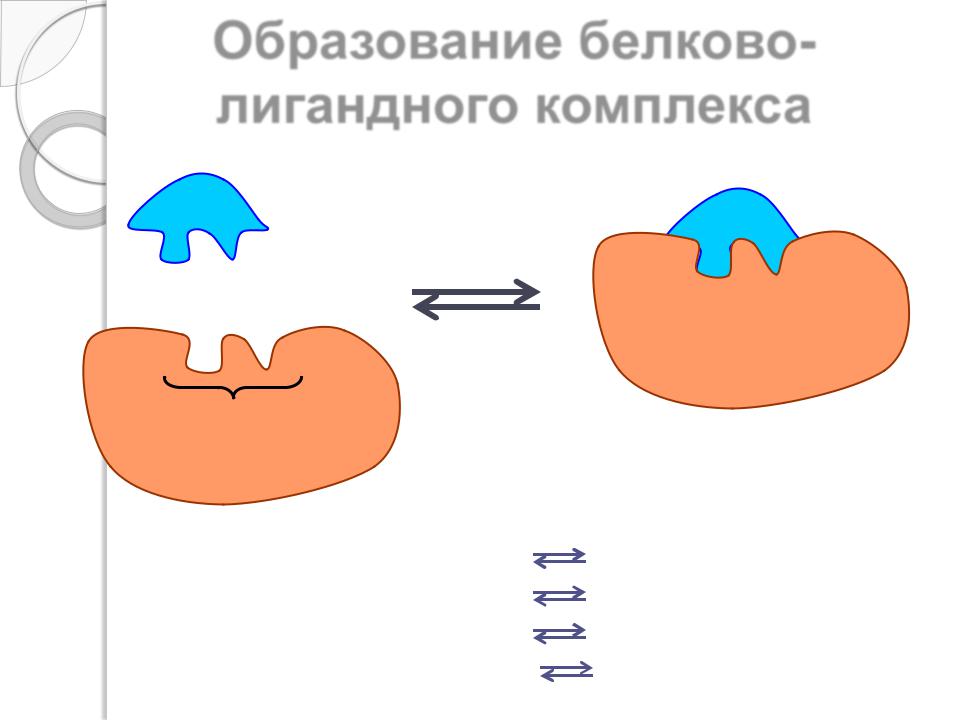
Образование белковолигандного комплекса
лиганд
+
активный |
белково-лигандный |
|
центр |
||
комплекс |
||
белок |
||
|
||
Фермент (Е) + субстрат (S) |
ЕS–комплекс |
|
Гормон (Г) + рецептор (Р) |
ГР–комплекс |
|
Актин (А) + миозин (М) |
АМ–комплекс |
|
Антитело (Ат) + антиген (Аг) |
Ат-Аг–комплекс |
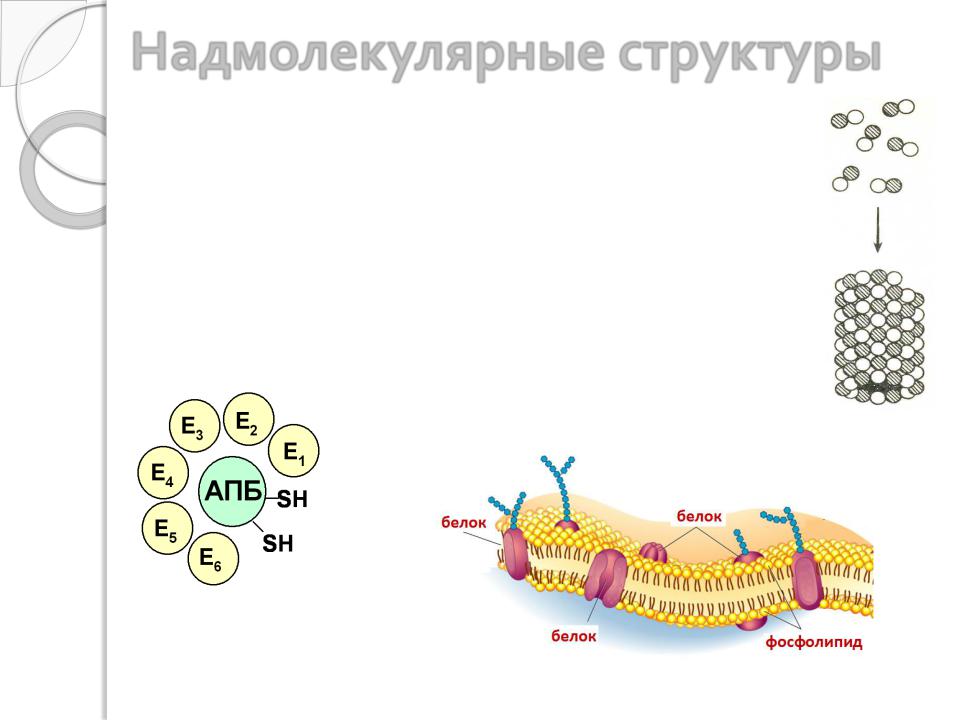
Надмолекулярные структуры
Многие белки функционируют не самостоятельно, а в составе надмолекулярных комплексов. Процесс самосборки таких комплексов отличается высокой специфичностью. Отдельные молекулы белка «узнают» друг друга и соединяются только между собой комплементарными поверхностями, и ошибочное соединение практически невозможно.
Примерами самосборки является образование молекулы вируса табачной мозаики, клеточных структур – мембран, рибосом, ферментных комплексов, микротрубочек и т.д.
Микротрубочки
Ферментный комплекс - |
|
синтетаза жирных кислот |
|
(Е – белки-ферменты, АПБ |
|
– ацилпереносящий белок) |
Мембрана |

Различие белкового состава
органов и тканей
В составе любых тканей присутствуют и одинаковые, и разные белки. Одинаковые во всех тканях белки выполняют общие функции – синтез нуклеиновых кислот, белка, образование энергии и т.д. Индивидуальные (специфичные) белки обеспечивают выполнение специфических функций органа или ткани и содержатся только в клетках такой ткани
Орган, ткань |
Белки |
|
|
Мышцы |
Актин, миозин |
|
|
Соединительная ткань |
Коллаген, эластин |
|
|
Эритроциты |
Гемоглобин |
|
|
Плазма крови |
Фибриноген, альбумины, |
|
иммуноглобулины |
|
|
Печень |
Ферритин, ферменты цикла |
|
мочевинообразования |
|
|

Количественно определить белок – значит установить его концентрацию в образце (растворе, пищевом продукте, сыворотке крови и пр.) Концентрацию белка выражают в г/л или в %
Методы количественного определения белков
|
Прямые |
Непрямые |
|
|
Гравиметрические; |
(по азоту) |
|
|
Колориметрические; |
||
|
|||
|
Оптические: |
|
|
-нефелометрические; |
|
||
-рефрактометрические; -спектрофотометрические

Непрямой метод (по азоту) основан на том, что любой белок содержит в своѐм составе 16% азота, и, если определить количество азота в образце, можно высчитать концентрацию белка в этом образце. Метод был разработан датским химиком Йоханом Кьельдалем и носит название «метод Кьельдаля». Определение проводят в несколько этапов:
1.Минерализация (связанный азот при нагревании органического вещества с концентрированной серной кислотой в присутствии
небольшого количества катализатора CuSO4 или других переходит в сульфат аммония).
2.Получение гидроксида аммония (после добавления щѐлочи образуется аммиак, который в водной среде существует в виде гидроксида аммония) и определение его количества методом титрования
3.Рассчет количества белка по определѐнному содержанию азота.
Метод Кьельдаля очень точный и дешѐвый, но очень трудоѐмкий и достаточной сложный в исполнении

Прямые методы основаны или на определении непосредственно количества белка в образце (гравиметрический, или весовой метод), или на измерении определѐнных физико-химических свойств белковых растворов, которые пропорциональны концентрации белках в этих растворах.
Гравиметрический метод – метод количественного химического анализа, основанный на точном измерении массы вещества. Пробу белкового раствора точно взвешивают, выпаривают растворитель, определяют количество сухого остатка и рассчитывают концентрацию исходного раствора.
Рефрактометрический метод.
Принцип метода основан на способности белковых частиц преломлять луч света. Степень рефракции зависит от концентрации веществ в растворе, физического состояния растворѐнных частиц, природы веществ в растворе, длины волны света, температуры.

Нефелометрический (турбидиметрический) метод.
Принцип метода основан на способности белковых частиц рассеивать свет. Чем выше концентрация белка в растворе, тем выше степень светорассеивания.
Спектрофотометрический метод основан на поглощении растворами монохроматического излучения, т.е. излучения с одной длинной волны в видимой или ультрафиолетовых областях спектра. Светопоглощение так же зависит от концентрации растворѐнного белка прямопропорционально. Спектрофотометрию чаще применяют при определении концентраций неокрашенных веществ.
Колориметрический метод определения концентрации белка очень схож со спектрофотометрическим, но используется для анализа окрашенных растворов. В основе метода лежит закон Ламберта-Бугера- Бэра о пропорциональности между интенсивностью окраски раствора и степенью поглощения им света.

Все прямые методы (за исключением гравиметрического) требуют предварительной подготовки, т.е установления зависимостей между концентрацией и показанием прибора. Для этого проводятся измерения большого количества образцов с известной концентрацией и строятся графики зависимости, или составляются таблицы, или выводятся уравнения , описывающие эту зависимость.
Однако в исследовательских или диагностических лабораториях пользуются уже готовыми методиками (с таблицами, графиками и т.п.), т.е. определив показания прибора (коэффициент преломления или оптическую плотность, или светорассеивание) по имеющимся таблицами и т.п. рассчитывают концентрации белка в анализируемых растворах.
В клинико-диагностических лабораториях пользуются только прямыми методами, т.к. они быстрые и простые в исполнении, хотя требуют дорогостоящего оборудования

Методы выделения
иочистки белков
Гомогенизация;
Экстракция;
Высаливание;
Диализ;
Хроматография;
Электрофорез.
