
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / 4. Введение в вирусологию
.pdfФазы взаимодействия сложноустроенного вирулентного бактериофага
с клеткой:
 Адсорбция (отростковой частью фага) на клеточной стенке бактерий. В эту фазу рецепторы базальной пластинки и нитей прикрепления специфически взаимодействуют с определенными рецепторами клеточной стенки бактерий.
Адсорбция (отростковой частью фага) на клеточной стенке бактерий. В эту фазу рецепторы базальной пластинки и нитей прикрепления специфически взаимодействуют с определенными рецепторами клеточной стенки бактерий.
На бактериях, лишенных клеточной стенки (L-формы, микоплазмы), фаги не адсорбируются.
 Проникновение нуклеиновой кислоты фага в клетку: происходит сокра-
Проникновение нуклеиновой кислоты фага в клетку: происходит сокра-
щение чехла отростка и растворение с помощью фагового лизоцима неболь-
шого участка клеточной стенки бактерии. Затем ДНК из головки бактериофа-
га через канал отростка инъецируется (впрыскивается) в цитоплазму клетки,
при этом оболочка фага остается на поверхности бактериальной клетки.
 Синтез фаговых частиц (подобно синтезу вирусов в эукариотической клет-
Синтез фаговых частиц (подобно синтезу вирусов в эукариотической клет-
ке): происходит репликация нуклеиновой кислоты бактериофага с образова-
нием множества копий, а на рибосомах бактериальной клетки – синтез фаго-
вых белков головки и отростка.
 Композиция фаговых частиц: происходит сборка белковых оболочек и нуклеиновых кислот и формируются зрелые бактериофаги.
Композиция фаговых частиц: происходит сборка белковых оболочек и нуклеиновых кислот и формируются зрелые бактериофаги.
 Выход фагов из бактериальной клетки путем лизиса клетки изнутри. Он осуществляется за счет свободного лизоцима, выделяемого множеством фа-
Выход фагов из бактериальной клетки путем лизиса клетки изнутри. Он осуществляется за счет свободного лизоцима, выделяемого множеством фа-
гов, что приводит к гибели бактерий в результате ее осмотического лизиса.
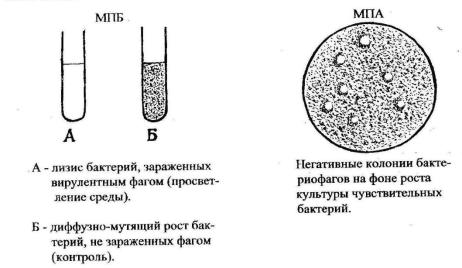
Репродукция вирулентного фага в популяции бактерий, выращенных в жидкой питательной среде (МПБ), сопровождается их лизисом и просветлени-
ем среды (рисунок 8а). В популяции чувствительных бактерий, выращенных сплошным газоном на плотной питательной среде (МПА), фаги образуют зоны очагового лизиса (рисунок 8б), которые называются «негативными колониями» или стерильными бляшками.
31
а) |
б) |
Рисунок 8 – Результат взаимодействия вирулентного бактериофага с бак-
териальной популяцией на жидкой и плотной питательной среде
Умеренные фаги чаще взаимодействуют с клеткой по типу интегративной вирусной инфекции: ДНК фага интегрируется с ДНК клетки и называется про-
фагом. Став частью хромосомы бактерии, профаг, при ее размножении, пере-
дается бактериальному потомству. Клетка, несущая профаг, называется лизо-
генной. Под влиянием различных факторов (УФ-света, некоторых химических веществ) связь профага с ДНК бактериальной клетки нарушается и профаг пе-
реходит в цитоплазму клетки, где размножается и ведет себя как вирулентный.
Практическое применение бактериофагов
I. Для диагностики инфекционных заболеваний используют метод фа-
готипирования, когда с помощью известного набора фагов определяют фаго-
вариант исследуемых бактерий. Метод основан на высокой специфичности фа-
гов, т.е. способности взаимодействовать только с бактериями, имеющими спе-
цифические рецепторы для адсорбции фага и лизиса этих бактерий. Фаготипи-
рование используют для диагностики брюшного тифа, дизентерии, холеры,
стафилококковых инфекций (рисунок 9).
32
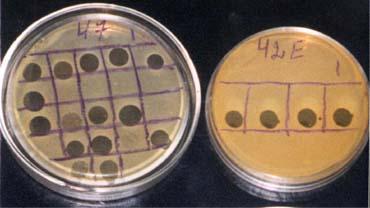
Рисунок 9 – Фаготипирование стафилококков с помощью набора различ-
ных типоспецифических фагов.
Метод фаготипирования имеет важное эпидемиологическое значение, т.к.
позволяет установить связи между источником инфекции и отдельными слу-
чаями заболевания. Выделение бактерий одного фаговарианта от разных боль-
ных указывает на общий источник их заражения.
II.Для лечения.
Однокомпонентные препараты бактериофагов:
-стафилококковый бактериофаг (при гнойно-воспалительных заболева-
ниях, вызванных стафилококками);
-бактериофаг P.aeruginosa (при гнойно-воспалительных заболеваниях,
вызванных синегнойной палочкой);
-клебсиеллезный бактериофаг (при заболеваниях, вызванных клебсиел-
лами).
Комбинированные многокомпонентные препараты бактериофагов:
-коли-протейный бактериофаг (для лечения эшерихиозов и дисбактерио-
зов, вызванных бактериями рода Proteus);
-пиобактериофаг (для лечения стафилококковой, стрептококковой, клеб-
сиеллезной, протейной, синегнойной инфекции и эшерихиозов);
-интести-бактериофаг (для лечения бактериальной дизентерии, сальмо-
неллезов, эшерихиозов, а также протейной, стафилококковой, энтеро-
кокковой и синегнойной инфекций).
33
Бактериофаги применяют местно путем аппликации на раневую или ожо-
говую поверхность, введением в полости (брюшную, плевральную, мочевой пу-
зырь), через рот, а также ректально. Соответственно способу применения пре-
параты бактериофагов выпускают в различных лекарственных формах (жидкая форма, таблетки, мази, свечи, аэрозоли). Перед назначением бактериофага
необходимо поставить пробу на чувствительность к нему выделенной
культуры микроорганизмов.
III.Для профилактики брюшного тифа и дизентерии у людей, контак-
тировавших с больным, используют брюшнотифозный и поливалентный дизен-
терийный бактериофаги.
3. Организация генетического материала бактериальной клетки. Факторы
внехромосомной наследственности.
Генетический материал бактериальной клетки представлен хромосом-
ной ДНК с гаплоидным набором генов. Хромосомная ДНК находится в супер-
спирализованной форме в виде кольца.
В бактериях могут присутствовать внехромосомные молекулы ДНК: плаз-
миды, транспозоны, вставочные последовательности.
Хромосомный и внехромосомный генетический материал свободно распо-
лагается в цитоплазме.
Факторы внехромосомной наследственности
Факторы внехромосомной наследственности (плазмиды, транспозоны,
вставочные последовательности) состоят из молекул ДНК, не являются жиз-
ненно важными для бактерий, но придают им новые свойства.
Плазмиды – кольцевидные молекулы ДНК, способные к саморепликации и несущие от 40 до 50 генов. Они находятся в автономном состоянии в цито-
плазме бактерий и способны к самопереносу из одной клетки в другую при конъюгации. Плазмиды кодируют свойства, дающие бактерии преимущества при попадании в неблагоприятные условия существования.
34
Плазмиды подразделяют на различные категории в зависимости от свойств, которые они кодируют у бактерий (таблица 7):
Таблица 7 – Классификация плазмид
Категории плазмид |
Свойства |
F-плазмида (от англ. fertility – |
Кодирует способность к переносу плазмид- |
плодовитость). |
ных и хромосомных генов при конъюгации |
|
бактерий через половые пили. |
R-плазмида (от англ. resis- |
Кодирует устойчивость бактерий к антибак- |
tance – противодействие) – |
териальным препаратам. |
плазмида резистентности. |
|
Плазмиды бактериоциноген- |
Кодируют синтез бактериоцинов (особых |
ности. |
белков), вызывающих гибель близкородст- |
|
венных бактерий. Например, бактериоцины |
|
E.coli вызывают гибель патогенных энтеро- |
|
бактерий. Бактериоцины могут быть полезны |
|
при лечении инфекций, вызванных антибио- |
|
тикорезистентными бактериями. |
Плазмиды патогенности. |
Кодируют синтез поверхностных бактериаль- |
|
ных антигенов, адгезинов, энтеротоксинов, |
|
гемолизинов и других факторов патогенности. |
Подвижные генетические элементы
Транспозоны – подвижные участки ДНК, которые способны перемещать-
ся внутри бактериальной хромосомы или между ДНК бактерий, плазмид и бак-
териофагов («прыгающие гены»). Помимо генов, кодирующих их способность к перемещению по ДНК, транспозоны могут содержать структурные гены,
обеспечивающие бактерию новыми свойствами (устойчивость к антибиотикам,
токсинопродукция и др).
Вставочные последовательности или инсерционные элементы (от англ. insertion sequens – вставочные последовательности) – простейший тип генети-
ческих элементов, мигрирующих между хромосомами, внутри хромосомы, ме-
жду хромосомой и плазмидами. Содержат гены, необходимые для их переме-
щения, новых свойств не кодируют.
35
Подвижные генетические элементы могут:
-распространять новые гены в популяции бактерий;
-координировать взаимодействие плазмид с хромосомой;
-вызывать изменения генов (мутацию, инактивацию) в местах их внедре-
ния в генетический материал.
Таким образом, внехромосомные молекулы ДНК бактериальной клетки способствуют разнообразным изменениям бактериального генома, появлению новых свойств и эволюционным изменениям микробной популяции в целом.
4. Виды генетической изменчивости. Использование генной инженерии в
медицине.
Мутации – это изменения последовательности нуклеотидов в бактериаль-
ной ДНК, которые ведут к изменению или утрате одного или нескольких фено-
типических признаков. Мутации у бактерий происходят с высокой частотой под влиянием очень многих внешних факторов, которые называются мутагена-
ми. Самые частые мутагены: УФ-, γ-лучи (физические), органические и неорга-
нические вещества (химические), транспозоны (биологические). Мутации бы-
вают: точечными (затрагивают один ген) и более протяженными (целый уча-
сток хромосомы). Они могут быть самопроизвольными и вызванными искусст-
венно. Мутации, которые приводят к возникновению новых полезных свойств,
обеспечивают выживаемость бактериальных популяции.
Генетические рекомбинации – это передача новых генов от одной клетки к другой с приобретением новых свойств, закодированных в этих генах. Гене-
тические рекомбинации отличаются друг от друга способом попадания в клетку новых генов.
Виды генетических рекомбинаций: трансформация, конъюгация,
трансдукция, фаговая конверсия.
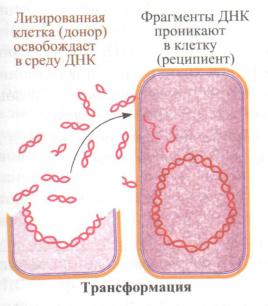
Трансформация – форма генетической изменчивости, при которой бакте-
рия-реципиент поглощает из внешней среды трофическим путем фрагменты ДНК погибшей бактерии-донора. Это приводит к образованию рекомбинант-
36
ных бактерий, обладающих некоторыми свойствами донорских клеток (рисунок
10).
Рисунок 10 – Трансформация у бактерий (схема)
Впервые феномен трансформации был установлен Ф. Гриффитсом в
1928 г. на модели бескапсульного и капсульного пневмококков (рисунок 11).
Следует напомнить, что капсула пневмококков – мощный фактор патогенности,
способствующий возникновению септического течения инфекции и гибели ла-
бораторного животного. Для проведения опыта в качестве индикатора исполь-
зовали 3 белые мыши. Первую мышь заражали живыми, бескапсульными неви-
рулентными пневмококками. Второй мыши вводили убитую культуру капсуль-
ных вирулентных пневмококков; третьей мыши – смесь живых бескапсульных пневмококков и убитых капсульных пневмококков.
В результате из всех мышей, взятых в опыт, погибала третья мышь, т.к.
живые бескапсульные пневмококки поглощали фрагменты ДНК убитых кап-
сульных, приобретали ген, кодирующий синтез капсулы, превращались в виру-
лентные пневмококки и убивали мышь.
37
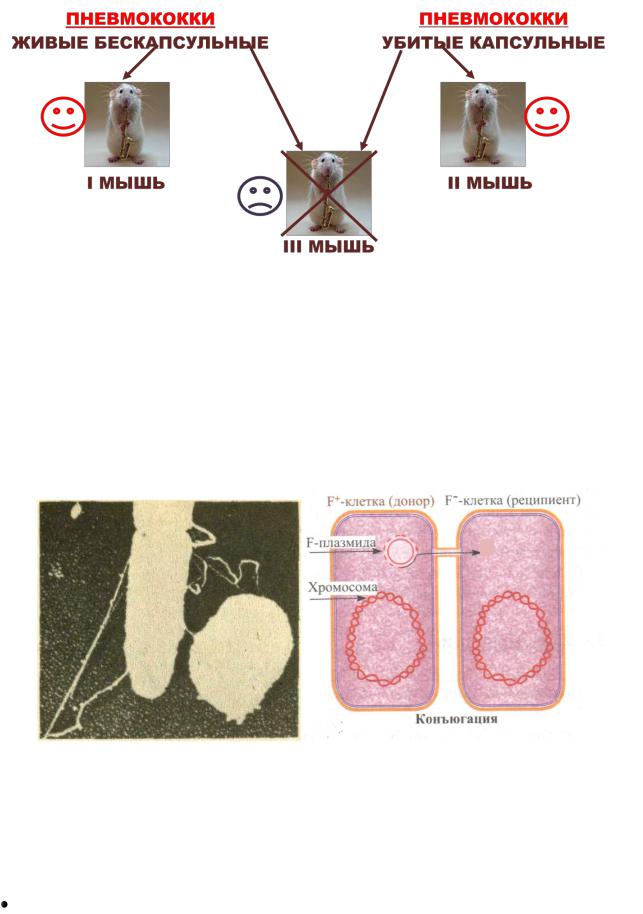
Рисунок 11 – Опыт Ф. Гриффитса по трансформации пневмококков
Конъюгация – передача генетического (хромосомного и нехромосомного)
материала от бактерии-донора к бактерии-реципиенту при их непосредствен-
ном контакте (рисунок 12). Необходимым условием для конъюгации является наличие у бактерии-донора F-плазмиды, которая контролирует синтез половых pili на поверхности клеток-доноров.
а) |
б) |
Рисунок 12 – Конъюгация у бактерий (а – электронная микроскопия, б – схема)
Процесс конъюгации между бактерией-донором (F+) и бактерией-
реципиентом (F-) имеет следующие стадии:
установление контакта между донором и реципиентом с помощью половых
pili;
38

прохождение генетического материала через канал половой pili от донора к реципиенту;
рекомбинация между донорской и реципиентной ДНК.
F-плазмида может находиться как в автономном состоянии в цитоплазме,
так и в интегрированном с хромосомой клетки. Находясь в автономном состоя-
нии, она контролирует только собственный перенос при конъюгации. В резуль-
тате F- клетка превращается в F+ клетку, содержащую F-плазмиду и способную к конъюгации. Если F-плазмида интегрирована с хромосомой бактерии, то при конъюгации она контролирует не только собственный перенос, но и перенос части хромосомной ДНК в клетку-реципиент. С помощью интегрированной F-
плазмиды частота переноса хромосомных генов между бактериями существен-
но возрастает.
Трансдукция – перенос небольшого фрагмента хромосомной ДНК от клетки-донора к клетке-реципиенту с помощью умеренного бактериофага (ри-
сунок 13). В результате трансдукции бактерия-реципиент приобретает новые фенотипические признаки (ферментативные свойства, устойчивость к антибио-
тикам и др.). При выходе бактериофага из клетки-реципиента, фрагмент донор-
ской трансдуцированной ДНК остается в хромосоме клетки, следовательно, со-
храняются и новые фенотипические признаки. Таким образом, при трансдукции умеренный бактериофаг выполняет только транспортную функцию.
Рисунок 13 – Трансдукция у бактерий
39
Фаговая конверсия (от лат conversion – превращение) – получение бакте-
рией новых свойств в результате использования генов профага, интегрирован-
ного с бактериальной хромосомой. Например, ДНК умеренного дифтерийного фага содержит ген, который кодирует синтез дифтерийного экзотоксина (ген tox). Если ДНК такого умеренного фага интегрируется с ДНК дифтерийной па-
лочки, то она превращается в токсигенную, т.е. продуцирующую дифтерийный экзотоксин. При выходе из клетки умеренного фага дифтерийные бактерии ут-
рачивают ген tox и теряют способность к продукции экзотоксина. Лизогенная конверсия выявлена также у возбудителей ботулизма, холеры и др.
Использование генной инженерии в медицине
 Получение живых вакцин. В основе лежит принцип аттенуации, предложен-
Получение живых вакцин. В основе лежит принцип аттенуации, предложен-
ный Л. Пастером. Аттенуация – ослабление вирулентности микробов под действием физических, химических или биологических факторов с сохране-
нием их иммуногенных свойств. Например, вакцинный штамм туберкулез-
ных бактерий (БЦЖ) был получен А.Ш. Кальметом и Ж-М.К. Жереном пу-
тем длительного (13 лет) выращивания возбудителя туберкулеза на пита-
тельной среде с желчью.
 Получение генно-инженерных вакцин (рекомбинантная дрожжевая вакцина против вирусного гепатита В содержит протективный HBs-антиген вируса).
Получение генно-инженерных вакцин (рекомбинантная дрожжевая вакцина против вирусного гепатита В содержит протективный HBs-антиген вируса).
 Разработка и внедрение в практику молекулярно-биологических методов ди-
Разработка и внедрение в практику молекулярно-биологических методов ди-
агностики инфекционных заболеваний, например, ПЦР.
 Получение штаммов бактерий и микроскопических грибов с высокой про-
Получение штаммов бактерий и микроскопических грибов с высокой про-
дукцией антибиотиков.
 Получение инсулина, гормонов, интерферона и других биологических ве-
Получение инсулина, гормонов, интерферона и других биологических ве-
ществ в бактериальных клетках с помощью генно-инженерных методов.
40
