
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Расписанные вопросы по химии
.pdf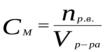
1.Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, нормальная концентрация, титр
ω [%]- массовая доля (процентная) концентрация, показывает сколько грамм растворённого вещества содержится в 100 г раствора и выражается формулой:
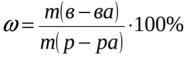 , где m (вещ-ва) – масса вещества,
, где m (вещ-ва) – масса вещества,
m (р-ра) – масса раствора, m (р-ра) = m (р-ля) + m (вещ-ва)
m (р-ра) =V∙ρ
Пример: ω (С6Н12О6) = 10%. Это означает, что в 100 г раствора глюкозы содержится 10 г С6Н12О6 и 90 г Н2О.
CМ [ моль/л или М ]– молярная концентрация, показывает какое количество молей растворённого вещества содержится в одном литре раствора и выражается формулой:
где n (X) – количество молей растворённого вещ-ва, V – объём раствора в литрах.
Пример: 2М NaOH – двумолярный р-р NaOH. Это означает, что в 1 л данного раствора содержится 2 моля NaOH.
0,1М – децимолярный р-р, 0,01М – сантимолярный р-р, 0,001М
– миллимолярный р-р.
СN [моль-экв /л или N ] – нормальная (эквивалентная)
концентрация показывает количество эквивалентов растворённого вещества в одном литре раствора и выражается формулой: ,
где nэ – количество эквивалентов в-ва (Х), V – объём раствора в литрах.
T. t – титрованная концентрация (титр) показывает сколько грамм растворённого вещества содержится в одном мл раствора и выражается формулой:
Пример: Т (Н2SO4) = 0,05 г/мл. Это означает, что в 1 мл данного раствора содержится 0,05 г Н2SO4.
2. Способы приготовления растворов (метод навески, метод разбавления, приготовление из фиксанала, метод смешивания)
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения,
доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
-вещество должно быть чистым (без примесей)
-иметь постоянный состав (соответствовать определённой химической формуле)
-быть устойчивым как на воздухе, так и в растворе
-иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7·10H2O), дихромат калия (K2Cr2O7).
Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2.Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3.Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал - ампула с сухим веществом или раствором с точно известным количеством эквивалентов. концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
5.Метод смешения заключается в том, что два вещества приводятся в термический контакт. В результате теплообмена система приходит в тепловое равновесие, ири котором температуры обоих веществ выравниваются. Если такой процесс провести в условиях, когда теплообмен с внешней средой исключен или может быть учтен, что свойственно для калориметров, то к системе применимо уравнение теплового баланса
3. Теория электролитической диссоциации Аррениуса: понятия “электролитическая диссоциация”, “электролит”. “ион”, “катион”, “анион”.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Ио́н — электрически заряженная частица вещества, которая образуется из атома или молекулы, когда они теряют или, наоборот, присоединяют один или несколько электронов.
Теория Электролитической диссоциации:
1.При растворении в воде электролиты распадаются на положительные ионы (катионы) и отрицательные ионы (анионы). ионы в растворе взаимодействуют с молекулами воды (гидратация). Процесс диссоциации является обратимым.
2.Под действием постоянного электрического тока катионы движутся по катоду, анионы – к аноду.
3.Степень диссоциации зависит от природы электролита и растворителя, концентрации электролита и температуры.
4.Степень диссоциации (α) электролита как количественная характеристика процесса диссоциации электролитов (деление электролитов на сильные и слабые по величине α). Факторы, влияющие на величину степени диссоциации.
Степень диссоциации (а) – отношение числа молекул, распавшихся на ионы (N’) к общему числу растворенных молекул (N): а = N’/ N;
Сильный электролит – вещество, степень диссоциации которого больше 30%.. к сильным электролитам относят все соли , сильные кислоты, сильные основания.
Слабый электролит – вещество, степень диссоциации которого меньше 3%. к слабым электролитам относят слабые кислоты, слабые основания.
Факторы :степень электролитической диссоциации зависит от природы растворенного электролита и природы растворителя, концентрации раствора, температуры, наличия посторонних веществ.
●Влияние температуры.При повышении температуры степень диссоциации слабых электролитов увеличивается.
●Влияние концентрации растворенного вещества.Увеличение содержания растворенного вещества в растворе приводит к уменьшению степени его диссоциации, так как каждая молекула растворенного вещества сможет взаимодействовать с меньшим количеством молекул растворителя. При разбавлении раствора водой, степень диссоциации
увеличивается
●Влияние одноименных ионов.Добавление к раствору слабой кислоты ее соли или более сильной кислоты приводит к уменьшению степени диссоциации. Увеличение концентрации любого из продуктов диссоциации приводит к сдвигу равновесия влево и увеличению концентрации непродиссоциировавших молекул кислоты. Это приводит к уменьшению степени диссоциации.
●Влияние природы растворителя.Чем выше полярность растворителя, тем больше степень диссоциации

растворенного в нем вещества, т.к. увеличивается сила взаимодействия ионов вещества с растворителем. Мерой полярности молекул растворителя может служить величина их дипольного момента.
●Влияние природы растворенного вещества.Под природой растворенного вещества в данном случае подразумевают природу химической связи в молекулах растворенных веществ. Чем больше полярность химической связи и чем меньше прочность связи в веществе, тем выше степень диссоциации.
5.Ступенчатый характер диссоциации слабых электролитов. Закон разбавления Оствальда (формулировка и математическое выражение)
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной
электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
где α — степень диссоциации.
К |
=С∙ ∙С∙ |
= |
С |
= |
С |
|
|
С( − ) |
С( − ) |
− |
|
|
|
6. Константа диссоциации слабых кислот и оснований (константа кислотности Ка, константа основности Кb) как константа равновесия процесса диссоциации. Показатель константы диссоциации (рКа и рКb).
Константа диссоциации – константа равновесия электролитической диссоциации. она равна отношению произведений концентраций ионов, образующихся при диссоциации, к концентрации исходных частиц.


Буферные системы
8. Какие растворы называются буферными растворами?
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении
небольшого количества сильной кислоты или основания.
9. Классификация буферных растворов. Примеры.
Различают в основном протолитические буферные растворы двух типов:
●Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СООизбыток сопряженного
кислота
основания
СН3СООNa → Na+ + CH3COO-
●Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+
NH4Cl → Cl- + NH4+ избыток сопряженной кислоты.
10. Уравнение для расчета pH буферных систем кислотного и основного типа(Гендерсона - Гассельбаха). Факторы,влияющие на значение рН буферных систем.
Уравнение Гендерсона-Гассельбаха (1908) - математическое (аналитическое) выражение, характеризующее возможности
буферной системы. Уравнение показывает, как зависит
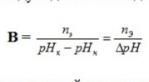
кислотно-основное равновесие буферного раствора от свойств компонентов кислотно-основной буферной системы и от количественного соотношения этих компонентов в растворе.
Показателем кислотно-основного равновесия в растворе является водородный показатель, pH. Свойство кислоты (её способность распадаться на ионы), как составляющей буферной системы, характеризуется значением константы равновесия, константы диссоциации кислоты, Kа. (или в логарифмической форме pKа= – lgK, в частности, если K = 10–11 , то pK = 11).
Количественная структура (состав) буферной системы может быть оценена в виде отношения соль/кислота (эквиваленты, эквивалентная масса). Учитывая сказанное, уравнение Гендерсона-Гассельбаха выглядит следующим образом:
pH = pKа+ lg (Ссоли/Скислоты).
На величину рН и рОН влияют константа диссоциации и соотношения концентраций компонентов.
11. Интервал буферного действия( определение и формула для расчета)
Буферное действие сохраняется в определенном интервале значений рН. Рабочий участок буферной системы, т.е. способность противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность одну единицу рН с каждой стороны. Вне этого интервала буферная емкость быстро падает до 0.
Интервал рН = рК ± 1 называется зоной буферного действия. Таким образом, на основе кислоты, имеющей определенное значение рК, можно приготовить буферные растворы,
поддерживающие значение рН в диапазоне от рК – 1 до рК + 1.
Где рК = –lgК
Пример: область действия ацетатного буфера 3,8 – 5,8; область действия гидрокарбонатного буфера 5,4 – 7,4, область действия гидрофосфатного буфера 6,2 – 8,2, область действия аммиачного буфера 8,2 – 10,2.
Установлено, что выраженное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более чем в 10 раз.
12. Буферная емкость( определение, формула для расчета, факторы,влияющие на значение буферной емкости).
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи) рНК – конечное значение рН (после добавления кислоты или щелочи)
рН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:

V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи, Vбуф.- объём буферного раствора
рН – изменение рН.
О противодействии изменению рН крови свидетельствуют следующие данные. Чтобы сдвинуть рН крови на единицу в щелочную область, нужно прибавить в кровь в 70 раз больше количества NaOH, чем в такой же объём чистой воды. Для изменения рН на единицу в кислую область, следует в кровь добавить в 320 раз больше количества соляной кислоты, чем к такому же объёму чистой воды.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью 14. Состав и механизм действия аммиачного буфера.
обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице.
13. Состав и механизм действия ацетатного буфера.
15. Состав и механизм действия бикарбонатного буфера.
Бикарбонатный буфер.
Он составляет 53 % буферной ёмкости и представлен: Н2СО3
NaHCO3 Соотношение 1 : 20
Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Механизм действия.
1. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2
2. При увеличении щелочности крови концентрация НСО3увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О.
Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным.
16. Состав и механизм действия гемоглобинового буфера.
Гемоглобиновый буфер. Составляет 35 % буферной ёмкости.
Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови.
Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами:
HHb ↔ H+ + Hb-
HHbO2 ↔ H+ HbO2-
Оксигемоглобин – более сильная кислота (рКа = 6,95), чем
гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов)
оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому
присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается.
Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СО3 ↔ КНСО3 + ННb.
Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот.
Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена.
Вкапиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2.
Влёгких: ННb + O2 ↔ HHbO2;
HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑
В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3-
Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер.
17. Состав и механизм действия белкового буфера.
Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием.
Pt – COOH - белок-кислота
Pt – COONa – белок-соль
1.При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + Pt-COONa ↔ Pt-COOH + NaCl. По закону разбавления В.Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется.
2.При увеличении щелочных продуктов они взаимодействуют с
Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O
Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется.
