
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Расписанные вопросы по химии
.pdf30.Функция состояния т\д системы: энтропия. 2 закон т\д.
Энтропия (S) -мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу. Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру. Например, при 0°С, то есть при 273 К, теплота плавления льда ∆Hпл = 5993,7 Дж/моль; возрастание энтропии при плавлении льда при этой температуре = 21,95 Дж/моль-К.
Энтропию относят к 1 молю вещества в стандартных условиях S°298 ; известно абсолютное значение энтропии для веществ; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль∙К = 1 э.е. Отсюда следует, что в любых изолированных системах(а в них могут совершаться только адиабатные процессы) энтропия системы сохраняет постоянное значение. Следовательно, в изолированных системах всякий самопроизвольно протекающий процесс сопровождается возрастанием энтропии. В случае закрытых систем энтропия в ходе процесса может, как
увеличиваться, так и уменьшаться. Процессы, для которых: 1) ∆S > 0 - расширение газов, фазовые превращения из твердого к жидкому и газообразному состоянию, растворение кристаллических веществ; 2) ∆S < 0 – сжатие газов, конденсация и кристаллизация веществ.
Второй закон термодинамики (второе начало термодинамики): Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0
Физический смысл энтропии: энтропия – это количество энергии, рассеянной 1 моль вещества, отнесенное к 1 градусу. Энтропия – экстенсивная функция. Энтропия пропорциональна массе, еѐ относят к 1 моль или 1 грамму вещества. Это означает, что энтропия системы равна сумме энтропий составных частей. Энтропия является функцией состояния системы. Это значит, что S характеризует систему, а не процесс. Еѐ изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода: ΔS=Sкон-Sисх

31. Функция состояния т\д системы: энергия Гиббса. Прогнозирование направления самопроизвольно
протекающих процессов в изолированной и закрытых системах; роль энтальпийного и энтропийного факторов.
Энергия Гиббса– функция состояния, являющаяся критерием самопроизвольности процессов в открытых и закрытых системах.
G=H–TS
H- энтальпия, Т- температура, - S- энтропия
Изменение ЭГ определяется формулой: ΔG=ΔH–TΔS Стандартная ЭГ определяется формулой:
Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG< 0 (для закрытых систем),ΔS> 0 (для изолированных систем)
В ходе самопроизвольного процесса в закрытых системах G уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (ΔrS) фактором. Для реакций, у которых ΔrH< 0 иΔrS> 0, энергия Гиббса всегда будет убывать, т.е. ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия

максимально возможное для данной системы значение Smax; в состоянии равновесияΔS= 0
32. Понятие экзергонических и эндергонических процессов, протекающих в организме.
Экзергонические процессы – химические реакции, в
результате которых уменьшается энергия Гиббса и система совершает работу.
Эндергонические процессы – химические реакции, в
результате которых воз-растает энергия Гиббса и над системой совершается работа.
Например, окисление глюкозы в крови процесс экзергонический, поскольку, сопровождается уменьшением энергии Гиббса, а в результате этой реакции возможно осуществлять различные виды работ в организме.
Кинетика
33. Скорость реакции: истинная и средняя скорость реакции( опред-е и мат.формула). Факторы,влияющие на скорость хим. реакции.
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при dt--->0
Факторы, влияющие на скорость хим. реакции Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ; 2) температура; 3) катализатор; 4) ингибитор.
Только для гетерогенных: 1) скорость подвода реагирующих веществ к поверхности раздела фаз; 2) площадь поверхности.
34.Закон действующих масс(ЗДМ). Выражение скорости химической реакции через ЗДМ. Константа скорости хим. р- ии. Факторы, влияющие на скорость и константу скорости хим. р-ии.
Основной постулат химической кинетики – закон
действующих масс аА + вВ = АВ
W = k [A]а∙[B]b
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в степени равной их молярным коэффициентам.
Эти степени называются частными порядками реакции:
а - частный порядок реакции по веществу А,
b - частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=a+b.
k - константа скорости реакции.( не зависит от значения концентраций реагентов)
Константа скорости химической реакции не зависит от концентрации реагентов, а определяется природой реагирующих веществ и условиями протекания реакций (температурой, наличием катализатора)
35. Классификации реакций, применяющиеся в кинетике: р- ии гомогенные и гетерогенные; р-ии простые и сложные(параллельные,последовательные, сопряженные, цепные). Примеры.
При изучении химических реакций различают реакции в гомогенных системах и в гетерогенных. Гомогенные реакции протекают в однофазных системах, они проходят по всему объему системы. Гетерогенные реакции протекают в системах состоящих из двух и более фаз (горение угля). Гетерогенные реакции идут только на поверхности раздела фаз, где реагирующие вещества соприкасаются друг с другом.
Кроме того, реакции бывают простыми и сложными. Простыми реакциями называются такие реакции, которые протекают в одну стадию в соответствии со стехиометрическим уравнением. Сложные реакции представляют совокупность простых реакций. К сложным реакциям относятся параллельные, последовательные, сопряженные, цепные.
Параллельные реакции – это реакции, протекающие одновременно в двух и более направлениях:
Примером параллельной реакции является разложение бертолетовой соли, которое идёт в двух направлениях:
3О2 + 2КCl ← 6KClO3 → 3KClO4 + KCl
При параллельных реакциях скорость всего процесса будет определяться в первую очередь скоростью наиболее быстрой стадии.
Последовательные реакции – это реакции с промежуточными стадиями:
А → В → С, где А – исходное вещество; В – промежуточное вещество; С – конечный продукт реакции. Примером такой реакции является реакция гидролиза трисахаридов в кислой среде:
С18Н32О16 + Н2О → С6Н12О6 + С12Н22О6 + Н2О → 3 С6Н12О6.
Сопряженные реакции – это такие сложные реакции, в которых одна реакция протекает только в присутствии другой:
А+ В → D (а),
А+ С → Е (б).
Реакция (а) идет самопроизвольно, тогда как (б) идёт только в присутствии первой реакции (а). Например, йодистоводородная кислота не окисляется хромовой кислотой непосредственно по реакции
6HI + 2H2CrO4 ↔ 3I2 + Cr2O3 + 5H2O.
Однако если в систему ввести FeO, который может непосредственно взаимодействовать с хромовой кислотой по реакции
6FeO + 2H2CrO4 = 3Fe2O3 + Cr2O3 + 2H2O,
То одновременно с окислением FeO начинается окисление HI.
Цепные реакции. Многие химические процессы представляют собой цепные реакции. К ним относятся некоторые гомогенные реакции окисления, галогенирования, расщепления, полимеризации и другие, обладающие такими особенностями, которые не могут быть объяснены основными положениями химической кинетики. Для цепных реакций характерны три стадии: зарождение цепи, ее развитие и обрыв.
36. Молекулярность элементарного акта р-ии. Порядок простой р-ии.
Число молекул,реагирующих в одном элементарном акте реакции, называется молекулярностью реакции.Если известно, что реакция является простой, то о ее молекулярности можно судить по стехиометрическому уравнению.
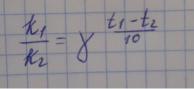
Реакция А → В называется одномолекулярной или
мономолекулярной. Реакция А + В = АВ является бимолекулярной, а реакция А + 2В = АВ2 – тримолекулярной.
Рассмотрим примеры:
N2O5 → NO2 + NO + O2 (мономолекулярная);
2 NO2 → N2O4 (бимолекулярная);
2NO + Cl2 → 2NOCl (тримолекулярная).
Молекулярность простых реакций совпадает с общим кинетическим порядком реакции. Порядок реакции определяет зависимость скорости от концентрации.
Порядок реакции – это сумма показателей степени при концентрации веществ в уравнении закона действующих масс.
Реакции могут быть 0-го,1-го,2-го,3-го, а также дробного порядка.Реакции дробного порядка характерны для сложных реакций,протекающих через промежуточные стадии,т.е имеющих более 1-го элементарного акта.
Нулевой порядок(n=0) наблюдается в таких гетерогенных реакциях,в которых скорость подвода больше во много раз химического. Скорость реакции не зависит от концентрации реагента Вид реакции: A ----->продукт.
Пример: CH3-CHO+O2---->CH3-COOH
Первый порядок(n=1)
Вид реакции: A ----- |
>продукт. Пример: CH3-COOC2H5+H2O---- |
>CH3-COOH+С2Н5ОН |
|
Второй порядок(n=2) |
|
Вид реакции: A+B--- |
>продукт или 2A---->продукт |
Пример: 2NO2--->2NO+O2
37. Зависимость скорости р-ии от температуры. Правило Вант-Гоффа.
При повышении температуры на скорость реакции ка каждые 10 градусов,скорость гомогенных реакций увеличивается в 2-4 раза
.
2)Повышение температуры увеличивает скорость движения молекул, вызывает возрастание числа столкновений между ними, увеличивается энергия всех видов молекулярных движений, поэтому в системе возрастает доля активных молекул.
38. Понятие о теории активных соударений. Энергия активации, ур-е Аррениуса.
Теория активных соударений Аррениуса основана на том,
что химическое взаимодействие осуществляется только при
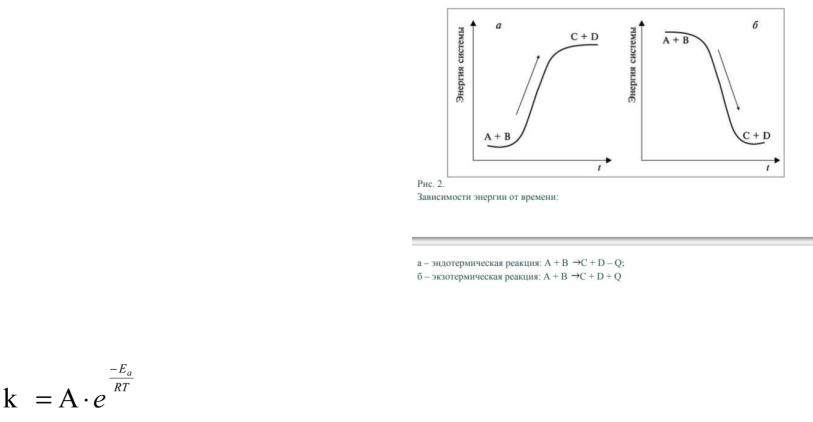
столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве относительно друг друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии, называемым энергией активацией.
Энергия активации - это та избыточная энергия, которой должны обладать молекулы для участия в химическом взаимодействии.
Активация вызывается повышением температуры, действием электрического поля, действием квантов и т.д.
Повышение температуры приводит к увеличению числа активных молекул, реагирующих веществ. Чем больше активных молекул, тем выше скорость химической реакции, следовательно выше константа скорости реакции.
Константа скорости определяется долей активных молекул, т.е числом эффективных столкновений. Взаимосвязь между константой и энергией активации выражается уравнением
Аррениуса
1) < кДжмоль−высокая скорость реакции
) > кДжмоль−при комнатной температуре реакции не протекают
39. Энергетический профиль реакции экзо- и эндотермической.
При рассмотрении тепловых эффектов химических реакций превращение молекул реагентов (А + В) в молекулы продуктов (С + D) c термодинамической точки зрения объясняется как «восхождение на энергетическую гору» в случае эндотермических реакций (рис. 2, а) или «спуск с горы» для экзотермических реакций (рис. 2, б). Молекулам реагентов, чтобы прореагировать, необходимо предварительно запастись дополнительной энергией, чтобы преодолеть энергетический барьер на пути к продуктам реакции. Существенно, что такой барьер имеется и в случае экзотермических реакций, так что вместо простого «соскальзывания с горки» молекулам
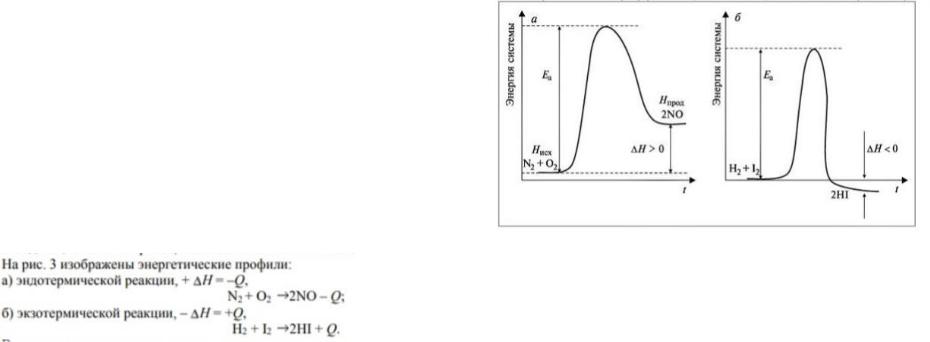
приходится предварительно «лезть в гору». Движущая сила реакции – стремление прийти к минимуму энергии.
Для того чтобы реакция могла протекать, частицы реагирующих веществ должны столкнуться друг с другом. С ростом температуры число этих столкновений возрастает вследствие увеличения кинетической энергии молекул, поэтому увеличивается скорость реакции. Но далеко не всякое соударение молекул реагирующих веществ приводит к их взаимодействию: для взаимодействия молекул связи между атомами в них должны стать слабее или порваться, на что должна быть затрачена определенная энергия. Если сталкивающиеся молекулы не обладают такой энергией, их столкновение не приводит к реакции. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию молекул нового вещества, называется энергией активации данной реакции Еа, обычно измеряется в Дж/моль, кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
.
В процессе реакции химические связи в активных молекулах ослабевают и возникают новые связи между частицами реагирующих веществ, образуется переходное состояние –
активированный комплекс, когда старые связи не полностью разрушены, а новые уже начали строиться.
Энергия активации – энергия, необходимая для возникновения активированного комплекса. Энергетический барьер различен, чем он ниже, тем легче и быстрее идет реакция.
Рис. 3. Энергетические профили эндои экзотермической реакций на примере образования оксида азота(II) NO (а) и йодоводорода HI (б) Точка, находящаяся на вершине энергетического барьера, носит название переходного состояния. Из этой точки система может свободно перейти в продукт реакции либо вернуться в исходное состояние.
40. Катализ. Понятие о гомогенном и гетерогенном катализе. Катализаторы положительные и отрицательные.

Явление катализа – это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде.
Разновидности катализа:
1)положительный – под действием некоторых веществ скорость реакции увеличивается;
2)отрицательный: под действием некоторых веществ скорость реакции уменьшается, такие вещества называются ингибиторами;
3)автокатализ: катализатором являются продукты реакции;
4)гомогенный: катализатор и реагенты находятся в одной фазе (газ или раствор);
5)гетерогенный: катализатор и реагенты находятся в разных фазах;
6)ферментативный: катализатором является биологический фермент.
Принципы катализа:
1)катализатор принимает участие в химической реакции, образуя промежуточные продукты, но в конце реакции выделяется в химически неизменном виде. Физическое состояние катализатора, входящего в активный комплекс, может существенно изменяться, например, уменьшатся размеры зерен твердого катализатора, изменится структура поверхностных слоев;
2)катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени;
3)действие катализатора является специфичным
(селективным); 4) катализатор увеличивает скорость реакции за счет
уменьшения Еакт, ведет реакцию по пути с меньшим энергетическим барьером.
Гомогенный катализ
Рассмотрим схему реакции, протекающей без катализатора:
A + B → AB* →C + D.
В присутствии катализатора реакция протекает в несколько стадий:
Гетерогенный катализ
В случае гетерогенного катализа реакции происходят на границе раздела фаз.
Гетерогенный катализ состоит из следующих стадий: 1. массоперенос реагентов к катализатору;

2.абсорбция – образование абсорбированного комплекса между реагентом и катализатором;
3.каталитическая реакция – образование продукта в основном адсорбированном состоянии;
4.десорбция продукта;
5.внутренний массоперенос (изнутри катализатора);
6.внешний массоперенос (из области реакции).
Простейший механизм гетерогенного катализа описывается схемой:
Для придания катализаторам большей избирательности, термической стойкости, механической прочности и активности их часто применяют в форме многокомпонентных систем: смешанных, на носителях, промотированных катализаторов.
Положительные катализаторы снижают величину энергии активации процесса. Так, в реакции СН3СНО → СН4+ СО без участия катализатора энергия активации составляет 216,7 кДж/моль, тогда как в присутствии паров иода (катализатор) Еакт = 143,0 кДж/моль.
Отрицательные катализаторы повышают энергию активации всей реакции. На скорость реакции в ряде случаев также влияет присутствие в системе ингибитора – вещества, уменьшающего скорость реакции.Механизм действия ингибиторов не связан с повышением энергии активации. Ингибиторы обычно препятствуют обычному течению реакции, вступая во взаимодействие с каким-либо промежуточным веществом, тем самым, удаляя его из реакционной смеси.
41.Энергетический профиль каталитической реакции.
Рис. 3: Энергетические профили реакций с катализатором и без него. Е1 – энергия активации некаталитической реакции, Е2 – каталитической реакции
Влияние катализатора на скорость химической реакции в основном заключается в его участии в этой реакции и изменении её механизма. Катализатор (Кат) образует с
