
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Расписанные вопросы по химии
.pdf
реагентами промежуточные активированные комплексы, которые в дальнейшем превращаются в продукты реакции и свободный катализатор:
42.Понятие о ферментативном катализе. Особенности каталитической активности ферментов.
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами биологического происхождения. Это белковые молекулы, называемые ферментами или энзимами.
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочнокишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин, панкреатин). При ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1)высокая специфичность;
2)эффективность действия;
3)биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (Е) с реагирующим веществом (субстратом S) и разрушение этого комплекса с образованием продуктов реакции (Р):
Химическое равновесие.
43.Обратимые и необратимые по направлению реакции.
Реакции, которые протекают , только в одном направлении и завершаются полным превращением исходных реагирующих в- в в конечные в-ва , называются необратимыми .
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2КСLO3 =2KCL+3O2
Реакция прекратиться тогда, когда весь хлорат калия превратиться в хлорид калия и кислород. Необратимых реакций не так много.
Обратимыми называются такие реакции,которые одновременно протекают в двух взаимно противоположных направлениях . Обратимым называется процесс, который можно в любой момент времени заставить протекать в обратном направлении, изменив какую-нибудь независимую переменную на бесконечно малую величину.
(Химическое равновесие-это такое состояние системы, при котором скорости прямой и обратной реакции равны между собой ) на всякий случай :)
44.Константа химического равновесия. Математическое выражение, физический смысл. Принцип Ле-Шателье. Термодинамические условия равновесия в термодинамических системах.
Константа химического равновесия — характеристика химической реакции , по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих в-в, о максимально возможном выходе продукта реакции при тех или иных условиях. Константа равновесия определяется экспериментально. Численное значение Kp характеризует положение равновесия при данной температуре и не меняется с изменением концентрации реагирующих в-в.
Кр=Кпр/Кобр
Отношение констант скоростей прямой и обратной реакций является величиной постоянной и называется константой равновесия.
Принцип Ле Шателье: Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов , определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие. Состояние термодинамической системы называется равновесным, если все свойства остаются постоянными в течение как угодно большого промежутка времени и в системе отсутствуют потоки в-ва и энергии.
Коллигативные свойства растворов.
45. Диффузия
Диффузия — процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения.
46.Осмос. Эндо- и экзосмос.
Самопроизвольный переход воды (растворителя) через полупроницаемую перегородку в раствор называется
осмосом.
Явление движения растворителя из окружающей среды в осмотическую ячейку называют эндосмосом.
Условия эндосмоса: Свнутр. > Снаруж.; πосм(внутр.) > πосм(наруж.). В результате эндосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор.
В растительном мире тургор помогает растению сохранять вертикальное положение и определѐнную форму. Если разница в концентрациях наружного и внутреннего раствора достаточно велика, а прочность оболочки клетки небольшая, то эндосмос приводит к разрушению клеточной мембраны и лизису клетки. Эндосмос является причиной гемолиза (гематолиза) – разрушения эритороцитов крови с выделением в окружающую среду гемоглобина.
Экзосмос – это движение растворителя из осмотической ячейки в окружающую среду.
Условия экзосмоса: Снаруж.> Свнутр.; πосм(наруж.) >
πосм(внутр.). В результате экзосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом. Экзосмос имеет место, если клетка оказывается в гипертонической среде. Явление экзосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса, рыбы – солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствии их плазмолиза.
47. Осмотическое давление ( закон Вант-Гоффа).
Давление, которое нужно приложить к раствору, чтобы прекратить осмос, называется осмотическим давлением, а приборы, служащие для измерения осмотического давления,
называют осмометрами.
Осмотическое давление является мерой стремления растворенного вещества (вследствие теплового движения его молекул) перейти в процесс диффузии из раствора в чистый растворитель и равномерно распределиться по всему объему растворителя. В 1887 г ботаник Пфеффер экспериментально установил две закономерности, которым подчиняется осмотическое давление неэлектролита.
1.В разбавленных растворах неэлектролита при данной температуре осмотическое давление прямо пропорционально концентрации πосм = К1С
2.При одной и той же концентрации С (моль/л) осмотическое давление разбавленного раствора прямо пропорционально абсолютной температуре πосм= К2С Закон Вант-Гоффа для осмотического давления
πосм = СRT,
где С – концентрация вещества в растворе, R – универсальная газовая постоянная, Т – абсолютная температура. Приведѐм формулировку закона, данную Вант-Гоффом: Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворѐнное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объѐм, равный объѐму раствора.
48. Роль осмоса в биосистемах(тургор, плазмолиз, гемолиз, изотонические растворы,гипертонические р-ры)
1. Осмос регулирует поступление воды в клетки и межклеточные структуры.
2. Упругость клеток (тургор), эластичность тканей, сохранение определенной формы органов обусловлены осмотическим давлением. Клетки некоторых растений развивают давление 4-
20 атм.
3. Растворы, имеющие одинаковое осмотическое давление называются изотоническими. Например, используются в медицине такие растворы как 0,9%-ный р-р NaCl и 5%-ный р-р глюкозы, которые изотоничны крови (т.е. имеют такое же осмотическое давление). Растворы с более высоким осмотическим давлением называются гипертоническими, а с более низким – гипотоническими. Осмотическое давление плазмы крови человека при 370С составляет около 7,6 атм, это давление создает электролитный состав крови: 60% этого давления создает NaCl, затем глюкоза и др.
4. Помещая клетку в дистиллированную воду, наблюдается эндосмос (молекулы воды проникают во внутрь клетки),
происходит набухание, а затем и разрыв оболочки и вытекание клеточного содержимого. Это явление называется лизисом. В случае эритроцитов – гемолизом. В концентрированных растворах солей отмечается сморщивание клеток - плазмолис, связанный с потерей воды, или экзосмосом.
5. Человеческий организм характеризуется постоянством осмотического давления, колебания его незначительны. Поэтому при различных процедурах в кровь человека в больших количествах можно вводить только изотонические растворы. При больших потерях крови (операции, травмы) больным вводят по несколько литров изотонического раствора NaCl (0,9%) для возмещения потери жидкости с кровью. Но следует помнить, что изотонический раствор кровь не заменяет!
6. В хирургии применяют гипертонические растворы, например 10%- ный р-р NaCl. Смоченную в таком растворе повязку накладывают на рану для очистки от гноя, микроорганизмов и продуктов распада.
7. Горькая соль MgSO4 *7H2O и глауберова соль Na2SO4*10 H2O являются сильными слабительными средствами. Это их свойство основано на осмосе: эти соли плохо всасываются желудочно-кишечном тракте, гипертонические растворы MgSO4 *7H2O и Na2SO4*10 H2O заставляют устремляться в просвет кишечника большое количество воды, что приводит к послабляющему эффекту.
8. Почка – эффективный осмотический аппарат. Основная функция ее заключается в удалении продуктов обмена из крови: в более концентрированный раствор – мочу - через полупроницаемую мембрану.
9. Одним из основных механизмов поступления минеральных веществ в эмаль зубов следует считать осмотическое
давление. Если эмаль покрыть высококонцентрированным раствором сахара, то осмотическое давление достигает 50 атм. Поэтому малые по размеру ионы, включая Н+ , будут интенсивно проникать в эмаль, что в конечном итоге приведет к кариесу.
49. Сформулируйте первый закон Рауля.
Давление пара, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворителя. Обозначим давление насыщенного пара чистого растворителя при данной температуре через Р0, а давление насыщенного пара растворителя над раствором неэлектролита через Р, тогда разность Р0 – Р = Р покажет величину понижения парциального давления пара над разбавленным бинарным раствором неэлектролита. Отнеся эту разность к давлению пара растворителя, получим так называемое относительное понижение давления пара растворителя:
= х1
х1 - молярная доля растворителя.
50. Сформулируйте второй закон Рауля.
Второй закон Рауля: Повышение температуры кипения или понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного вещества и не зависят от его природы. Математическое выражение:
∆Tкип =Eb
E- эбулиоскопическая константа b- моляльность раствора
∆Tзам =Kb
K-криоскопическая константа
51.Поверхностные явления - совокупность процессов и явлений на границе раздела фаз, обусловленных свойствами поверхности.
Поверхностное натяжение — термодинамическая х-ка пов-и раздела 2 фаз, находящихся в равновесии.
Капиллярные явления - явления, вызываемые влиянием сил межмолекулярного взаимодействия на равновесие и движение. Поверхностная активность - способность растворенных в-в изменять ПН растворителя.
Смачивание - явление, возникающее при взаимодействии Ж с поверхностью Т, обусловленное силами притяжения и отталкивания молекул Ж и Т.
Адгезия - способность сцепления между приведенными в контакт пов-ями 2 разнородных тел. Примеры: стремление капель Ж / пузырьков Г принять сферическую форму, коагуляция, слипание капель в эмульсиях / пузырьков Г в пенах, рост кристаллов.
52. Поверхностное натяжение -избыток поверхностной энергии, проходящей на 1м2 межфазной поверхности.

Механизмы возникновения поверхностного натяжения
Молекула жидкости в поверхностном слое находится под действием сил притяжения соседних молекул. Равнодействие этих сил направлено в глубь жидкости и старается сократить поверхность. Передвижение молекул из глубины раствора требует затрат энергии на совершение работы по преодолению сил межмолекулярного сцепления, это работа по созданию единиц поверхности поверхностного натяжения.
Факторы, влияющие на величину поверхностного натяжения:
●на границе ж-ж зависит от природы соприкасающихся фаз:чем больше разность полярностей фаз, тем больше поверхностное натяжение на границе их раздела
●поверхностное натяжение жидкостей уменьшается с ростом температуры
●в системе жидкость-газ с повышением давления пов. натяжение уменьшается
53.Адсорбция вещества - обратимый процесс,
заканчивающийся установлением адсорбционного равновесия,
при котором скорость адсорбции равна скорости обратного процесса – десорбции.
Адсорбция - изменение концентрации растворённого вещества в поверхностном слое раствора (или вообще на границе раздела фаз) называется.
Адсорбент- это твердое вещество, на поверхности которого накапливается другое вещество.
Адсорбтив – это вещество, которое адсорбируется. Адсорбат - это уже адсорбированное вещество. Десорбция – обратный процесс адсорбции.
В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбции.
54. Физическая адсорбция обусловлена межмолекулярным взаимодействием за счёт сил Ван-дер-Ваальса (ориентационных, индукционных и дисперсионных) или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецифичность, экзотермичность.
Примеры: древесный уголь поглощает некоторые газы ( СО2,H2,NH3 и др.)- адсорбция аммиака на угле
Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Энергия возникающих при этом связей 40 – 400 кДж/моль. Хемосорбция практически необратима, специфична и локализована. Повышение температуры усиливает химическую адсорбцию.
Пример: химическая адсорбция: адсорбция углекислого газа на извести CaO + CO2 =CaCO3 При повышении температуры физ.адсорбция уменьшается, а хемосорбция – увеличивается.

|
– температура, при которой происходит адсорбция, R – газовая |
|
55.На границе раздела жидкость — газ (вода — воздух) могут |
постоянная, dc d – поверхностная активность. |
|
самопроизвольно адсорбироваться молекулы поверхностно- |
Если |
< 0, то Г > 0, т.е. адсорбция положительна |
активных веществ (ПАВ). Они формируют пограничные |
(вещество накапливается на поверхности раздела фаз), это |
адсорбционные слои, которые способны радикально изменять |
характерно для ПАВ. |
свойства поверхности раздела фаз и дисперсных систем. |
Если же > 0, то Г < 0, т.е. адсорбция отрицательна (вещество |
Поверхность жидкости однородна, молекулы в поверхностном |
накапливается в объёме), это характерно для ПИВ. |
слое подвижны, а поверхностное натяжение, вызванное |
|
нескомпенсированностью межмолекулярного взаимодействия |
Уравнение Гиббса отражает следующую зависимость: чем |
на границе жидкости с газовой средой одинаково по всей |
сильнее уменьшается поверхностное натяжение с увеличением |
площади раздела фаз. Адсорбция приводит к изменению |
концентрации адсорбируемого вещества, тем больше его |
поверхностного натяжения. Эти изменения зависят от |
поверхностная активность. Это свидетельствует о том, что знак |
концентрации адсорбтива. По мере роста концентрации |
«минус» указывает на обратную зависимость между величиной |
растворенного вещества (адсорбтива) поверхностное |
адсорбции Г и поверхностным натяжением σ. |
натяжение может снижаться или увеличиваться. Вещества, |
|
снижающие в результате адсорбции поверхностное натяжение |
Изотерма Гиббса: |
жидкости, называются поверхностноактивными, а вещества, |
|
поверхностное натяжение растворов которых по отношению к |
Рис. 2. Изотерма адсорбции Гиббса. |
растворителю увеличивается, — поверхностноинактивными. |
|
Уравнение Гиббса: Дж. Гиббс на основе второго закона |
|
термодинамики в 70-х гг. XIX в. вывел важное уравнение, |
|
связывающее величину адсорбции со способностью |
|
растворённого вещества изменять поверхностное натяжение |
|
раствора: |
|
где Г – количество адсорбированного вещества, моль/м2 ; с – молярная концентрация растворённого вещества, моль/дм3 , Т
Из графика видно, что по мере увеличения концентрации вещества адсорбция возрастает вначале резко, а затем всё медленнее и медленнее, асимптотически приближаясь к некоторой величине предельной адсорбции Г∞. Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определённую площадь и при достижении определённой концентрации ПАВ в растворе (С∞) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна (однослойна), дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
56.Поверхностно активные ПАВ.
Если растворенное вещество понижает поверхностное натяжение (σ<0), то его поверхностная активность положительна (g>0); такие вещества называются
поверхностноактивными веществами (ПАВ). В водных растворах свойства ПАВ проявляют многие органические вещества, например, спирты и кислоты алифатического ряда, сложные эфиры, белки и др.
Многие растворенные вещества незначительно повышают поверхностное натяжение (σ>0). Поскольку их поверхностная активность отрицательна (g<0), их называют
поверхностноинактивными веществами (ПИВ). К таким веществам в водных растворах относятся многие
неорганические кислоты, основания и соли, полярные молекулы и ионы которых сильнее взаимодействуют с водой,
чем между собой. Свойства ПИВ проявляют и некоторые
органические соединения, например,-аминокислоты.
Известны и вещества, которые не изменяют поверхностного натяжения жидкости, в которой они растворены (σ= 0;g= 0).
Такие вещества относят к поверхностно-неактивным веществам (ПНВ). По отношению к воде такие свойства проявляет сахароза и другие сахара.
Механизм действия ПАВ и ПИВ:
57. Ориентация молекул ПАВ в поверхностном слое
(принцип Ленгмюра). Правило Дюкло-Траубе.
Поскольку только полярная головка ПАВ растворима в воде, а гидрофобный хвост нет, то такие молекулы выталкиваются на поверхность, где и накапливаются - это пример
положительной адсорбции. Пределом такой адсорбции служит полное насыщение поверхностного слоя адсорбируемыми веществами.
Если вещество увеличивает поверхностное натяжение, то оно втягивается во внутренние слои жидкости. Это отрицательная адсорбция, поскольку поверхностные слои обедняются растворенным веществом.
Лэнгмюр сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа, обладающая большим сродством к полярной фазе - воде, втягивается в воду, в то время, как неполярный радикал выталкивается в неполярную фазу.
Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется так называемый
мономолекулярный слой.
Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза. Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части и неполярной части. В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличении углеродного радикала на одну -СΗ2-группу.
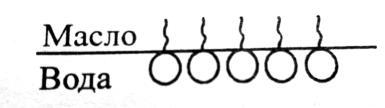
58. Адсорбция на границе двух несмешивающихся жидкостей
Это образец двух несмешивающихся жидкостей. Например, система масло-вода. Если добавить в такую систему какоелибо вещество, то оно растворится в той жидкости, молекулы которой близки ему по характеру межмолекулярного взаимодействия. Вспомним правило: <<подобное растворяется в подобном так>>. Так, хлорид натрия практически полностью перейдет воду, а йод в масло. Если внести в такую систему дифильные молекулы, то они распределятся таким образом:
Врезультате компенсируются межмолекулярные силы и снижается σ обеих жидкостей. На этом явлении основана стабилизация эмульсий. Так, молоко, сливки-в них капельки эфира стабилизированы белком. Известно также искусственные эмульсии: маргарин, майонез, мороженое, косметика, некоторые лекарственные формы.
Ворганизме: кровь, лимфа, жиры стабилизирована белком, жировая эмульсия в кишечнике стабилизируется желчными и жирными кислотами. В результате этого понижается σ пищевых соков, пища лучше смачивается, дробится, эмульгируется и всасывается. Хороший эмульгатор-горчица-приправа к жирной пище. Моющее действие мыла и СМС объясняется также их эмульгирующим действием.
59. Изучая адсорбцию на твердых поверхностях Ленгмюр предложил теорию мономолекулярной адсорбции и уравнение адсорбции.
Основные положения теории Ленгмюра следующие:
- адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах, где
имеются участки с наиболее нескомпенсированными силовыми полями; - каждый адсорбционный центр может удерживать только
одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что приводит к образованию мономолекулярного слоя поглощаемого вещества;
- процесс адсорбции обратим и носит динамический характер, т.к. адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция такого же числа новых молекул.
Исходя из этих положений, Ленгмюр предложил уравнение адсорбции:
Где Г∞ - значение предельной адсорбции; с – равновесная концентрация адсорбента в системе; К – константа адсорбционного равновесия.
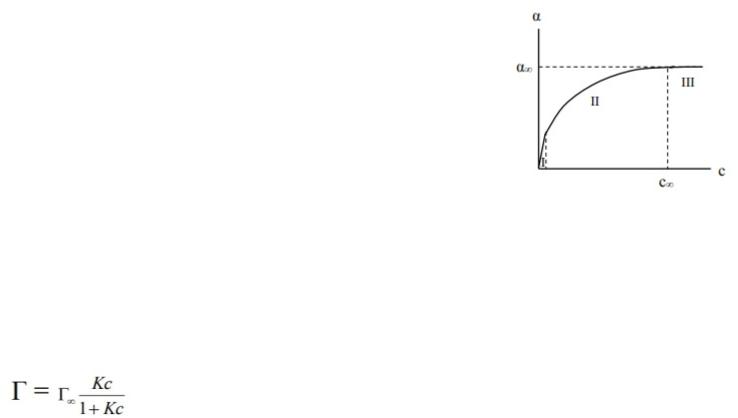
Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид:
Рис. 4. Зависимость адсорбции от концентрации ПАВ
На кривой четко видны три участка: I - ый участок – это прямая линия, выходящая из начала координат. Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞∙Кс, т.е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата. III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой). II – ой участок соответствует
