
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Расписанные вопросы по химии
.pdfБелок – это амфотерный электролит и поэтому проявляет
собственное буферное действие.
Рассмотрим взаимодействие буферных систем в организме по стадиям:
1. В процессе газообмена в легких кислород поступает в эритроциты, где протекает реакция:
ННb + O2 ↔ HHbO2 ↔ Н+ + HbO2-
2. По мере перемещения крови в периферические отделы кровеносной системы происходит отдача кислорода ионизированной формой HbO2-
HbO2-↔ Нb- + О2
Кровь при этом из артериальной становится венозной. Отдаваемый в тканях кислород расходуется на окисление различных субстратов, в результате чего образуется СО2, большая часть которого поступает в эритроциты.
3. В эритроцитах в присутствии карбоангидразы со значительной скоростью протекает следующая реакция:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
4. Образующийся избыток протонов связывается с гемоглобинатионами:
Н+ + Нb- → HHb
Связывание протонов смещает равновесие реакции стадии (3)
вправо, вследствие чего концентрация гидрокарбонат ионов возрастает и они диффундируют через мембрану в плазму. В результате встречной диффузии ионов, отличающихся кислотноосновными свойствами (хлорид-ион протолитически неактивен; гидрокарбонат ион в условиях организма является основанием), возникает гидрокарбонатно-хлоридный сдвиг. Этим объясняется более кислая реакция среды в эритроцитах (рН = 7,25) по сравнению с плазмой (рН = 7,4).
5. Поступающие в плазму гидрокарбонат-ионы нейтрализуют накапливающийся там избыток протонов, возникающий в результате метаболических процессов:
НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2
6. Образовавшийся СО2 взаимодействует с компонентами белковой буферной системы:
СО2 + Рt-NH2 ↔ Pt-NHCOOH ↔ H+ + Pt-NHCOO-
7. Избыток протонов нейтрализуется фосфатным буфером:
Н+ + НРО4- ↔ Н2РО4-
8. После того как кровь вновь попадает в легкие, в ней увеличивается концентрация оксигемоглобина (стадия 1), который реагирует с гидрокарбонат-ионами, не диффундировавшими в плазму:
НСО3- + ННbО2 ↔ НbО2- + СО2 + Н2О
Образующийся СО2 выводится через легкие. В результате
уменьшения концентрации НСО3ионов в этой части кровеносного русла наблюдаются их диффузия в эритроциты и диффузия хлоридионов в обратном направлении.
9. В почках также накапливается избыток протонов в результате реакции:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-,
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер): H+ + NH3 ↔ NH4+
Таким образом, гемоглобиновая система участвует в двух процессах:
·Связывание протонов, накапливающихся в результате метаболических процессов;
·Протонирование гидрокарбонат-ионов с последующим выделением СО2
18. Состав и механизм действия фосфатного буфера.
Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-.
Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4 : 1. Следовательно, эта система имеет буферную ёмкость по кислоте
больше, чем по основанию.
Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2- :
Н + + НРО4 2- ↔ Н2РО4 1-
Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 1-:
ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О
Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается.
Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез, в моче.
19. КОР( кислотно-основное равновесие организма). Основные показатели КОР.
Кислотно-основное состояние – неотъемлемая составная часть
протолитического гомеостаза внутренней среды организма, который обеспечивает оптимальные условия правильного течения обмена веществ.Соотношение определённой концентрации ионов Н+ и ОН- в органах, тканях, жидкостях организма называется кислотно-основным равновесием (КОР). Кислотно – основное равновесие имеет первостепенное значение, так как:
·Ионы Н+ являются катализаторами многих биохимических превращений;
·Ферменты и гормоны проявляют биологическую активность при строго определённых значениях рН;
·Наибольшие изменения концентрации ионов Н+ крови и межтканевой жидкости влияют на величину их осмотического давления.
Отклонение рН крови (7,4) на 0,3 ед. может привести к коматозному состоянию, отклонение на 0,4 ед. может повлечь смертельный исход. рН слюны равное 5 ед. приводит к развитию кариеса.
Основные показатели КОР.
·В норме рН крови равно 7,4. смещение рН в сторону увеличения называется алкалозом, а в сторону уменьшения – ацидозом. Различают респираторный и метаболический ацидоз и алкалоз.
·Парциальное давление СО2 в норме составляет 40 мм рт.ст. Снижение этого показателя наблюдается при дыхательном алкалозе и метаболическом ацидозе. Повышение давления СО2 отмечается при дыхательном ацидозе и метаболическом алкалозе.
·Щелочной резерв крови. Это количество мл СО2, находящегося в крови, в расчете на 100 мл сыворотки крови. Норма – 55 %. Уменьшение резервной щелочности свидетельствует об уменьшении
содержания бикарбонатов в организме, а увеличение её – об
увеличении их.
Возможные причины и типы нарушения КОР организма.
Нарушение кислотно-основного состояния возникает в результате нарушения транспорта СО2 в организме или при изменении его концентрации во вдыхаемом воздухе.
В зависимости от механизма развития расстройств кислотноосновного состояния выделяют дыхательный и метаболический ацидозы и алкалозы.
Метаболический ацидоз характеризуется нарушением метаболизма, которое приводит к нескомпенсированному или частично компенсированому падению рН крови.
Метаболический ацидоз некомпенсированный наступает вследствие:
а) избыточного введения или образования стойких кислот (поступление кетокислот при голодании и диабете, б) повышеное образование молочной кислоты при шоке,
в) задержка фосфатов, сульфатов, анионов органических кислот в результате снижения величины клубочковой фильтрации в почках, г) избыточной потери гидрокарбонат-иона в результате поноса, колита, язвы кишечника.
Процессы компенсации связаны с нейтрализацией ионов водорода гидрокарбонат-ионом и усилением лёгочной вентиляции.
Метаболический алкалоз характеризуется нарушением метаболизма, которое приводит к некомпенсируемому или частично компенсируемому увеличению рН крови.
Метаболический алкалоз наступает в результате:
а) потери водородных ионов (высокая кишечная непроходимость, неукротимая рвота и др.); б) увеличение концентрации гидрокарбоната (потеря воды,
избыточное введение гидрокарбонат-ионов при метаболическом ацидозе, введение солей органических кислот – молочной, уксусной, лимонной, метаболизирующих с поглощением ионов водорода и др.), в) избыток выведения ионов калия при повышенной секреции минералокортикоидов
Компенсации этого явления достигают снижения лёгочной вентиляции (задержка СО2), удалением гидрокарбонат-иона почками.
Дыхательный ацидоз – это нескомпенсированное или частично компенсированное снижение рН в результате гиповентиляции из-за:
а) заболевания лёгких или дыхательных путей (пневмония, отёк лёгких, инородные тела в верхних дыхательных путях и т.д.); б) повреждения (заболевания) дыхательной мускулатуры в) угнетении дыхательного центра лекарственными средствами или наркотиками – опиатами, барбитуратами и т.п.
Дыхательный алкалоз – это нескомпенсированное или частично компенсированное повышение рН в результате гипервентиляции изза лихорадочного состояния или истерии. Процессы компенсации осуществляются буферными системами, повышенным выведением гидрокарбонат-иона почками.
При нарушении КОР в организме быстро включается буферная компенсация (через 10-15 мин). Легочная компенсация развивается в норме в течение 10-18 часов и заключается в стабилизации
отношения [HCO3‾]/[ Н2СО3] путем изменения объёма легочной
вентиляции. Почечная компенсация связана с включением ряда
дополнительных ферментативных процессов, поэтому она развивается в течение 2-3 суток.
Комплексные соединения.
20.Теория строения комплексных соединений (теория Вернера): внутренняя и внешняя сфера, комплексообразователь, лиганды, координационное число, дентантность.
По Вернеру главной валентностью называется валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности. Но, исчерпав главную валентность, атом способен, как правило, к дальнейшему присоединению за счет побочной валентности, в результате проявления которой и образуется комплексное соединение.
Под действием сил главной и побочной валентности атомы стремятся равномерно окружить себя ионами или молекулами и являются таким образом центром притяжения. Такие атомы называются
центральными или комплексообразователями. Ионы или молекулы,
непосредственно связанные с комплексообразователем, называются
лигандами.
Посредством главной валентности присоединяются лиганды ионы, а посредством побочной валентности – ионы и молекулы.Притяжение лиганд к комплексообразователю называется координацией, а число лиганд – координационным числом комплексообразователя.
Можно сказать, что комплексные соединения это соединения, молекулы которых состоят из центрального атома (или иона)
непосредственно связанного с определённым числом других молекул
или ионов, называемых лигандами.
В роли комплексообразователей чаще всего выступают катионы металлов (Со+3, Рt+4, Cr+3, Cu+2Au+3 и др.)В качестве лигандов могут выступать ионы Cl-, CN-, NCS-, NO2-, OH-, SO42так и нейтральные молекулы NH3, H2O, амины, аминокислоты, спирты, тиоспирты, РН3, эфиры.
Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостью или дентатностью.Лиганды, присоединенные к комплексообразователю одной связью, занимают одно координационное месть и называются монодентатнымия (Cl-, CN-, NCS-). Если же лиганд присоединён к комплексообразователю посредством нескольких связей, то он является полидентатным. Например: SO42- , СО32-являются бидентатными.
Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу.Ионы внешней сферы связаны менее прочно по сравнению с лигандами и пространственно удалены от комплексообразователя. Они легко замещаются другими ионами в водных растворах.
Как правило координационное число равно удвоенному заряду катиона металла, например: однозарядные катионы имеют координационное число равное 2, 2-х зарядные – 4, а 3-х зарядные – 6. если элемент проявляет переменную степень окисления, то с увеличением её координационное число растет. Для некоторых комплексообразователей координационное число является
постоянным, например: Со+3, Рt+4, Cr+3 имеют координационное
число равное 6, у ионов В+3, Ве+2, Сu+2 , Au+3 координационное
число равно 4. для большинства ионов координационное число является переменным и зависит от природы ионов внешней сферы и от условий образования комплексов.
21. Комплексообразующая способность s, p, d элементов. Ее причины.
Комплексообразующая способность катионов определяется следующими факторами:заряд катиона, радиус катиона и электронная конфигурация катиона.
Чем больше заряд катиона и меньше радиус, тем прочнее связь комплексообразователя с лигандами. Поэтому катионы s- элементов (К+, Nа+, Са+2, Мg+2 и др.) обладающие относительно большим радиусом и малым зарядом, имеют низкую комплексообразующую способность. Катионы d-элементов (Со+3, Рt+4, Сr+3и др.), имеющие, как правило небольшой радиус и высокий заряд, являются хорошими комплексообразователями.
d-элементы имеют большое количество валентных орбиталей, среди которых имеются свободные орбитали и с неподелёнными электронными парами. Поэтому они одновременно могут быть и донорами и акцепторами. Если аналогичной возможностью обладает и лиганд, то одновременно с σ- связью (лиганд донор, а комплексообразователь является акцептором), образуется и π-связь (лиганд акцептор, а комплексообразователь – донор). При этом происходит увеличение кратности связи, что обуславливает высокую прочность d- элементов со многими лигандами. Эта связь называется
дативной связью.
22-23. Классификация КС по заряду внутренней сферы и
характеру лиганда. Номенклатура КС.

1. По заряду комплексного иона различают:
катионные [Cu(NH3)4]2 анионные [Co(NO3)6]3- нейтральные [Pt(NH3)Cl2]0
2. По характеру лигандов различают:
акво- [Сu(H2O)4]SO4
аммино-[Cu(NH3)4]SO4
ацидоК2[Cu(Cl)4]
гидроксо-K2[Cu(OH)4]
По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы. Они образуются катионом металла и ɑ-аминокислотами. К ним относятся гемоглобин, хлорофилл, витамин В12.
При составлении названия комплексных соединений руководствуются следующими правилами:
Сначала называют внутреннюю сферу.
Составные части её называют в следующей последовательности: лиганды анионы, лиганды – молекулы, комплексообразователь. Записывают формулу в обратной последовательности.
К названиям лигандов – ионов добавляют окончание «о» (Сl—хлоро-, СN—циано-). Нейтральные молекулы сохраняют свои названия, за исключением Н2О – акво, NН3 – амин.
Число лигандов указывают греческими числительными: ди, три-, тетра-, пента-, гекса- и т.д.
В последнюю очередь называют ионы внешней сферы.
Пример: катионные –[Cu(NH3)4 ]SO4 – тетраамминокупрат (II)
сульфат; анионные – Na3[Co(NO2)6] –гексанитрокобольтат (III) натрия; нейтральные [Pt(NH3)]Cl2 - дихлородиамминоплатина.
24. Диссоциация КС в растворе, константы нестойкости и стойкости КС.
Ионы внешней сферы соединены с комплексом ионной связью, поэтому в водных растворах они легко отщепляются: [Fe(Н2О)6]SO4 ↔ SO42- + [Fe(Н2О)6]2+.
Этот процесс называется первичной диссоциацией. Внутренняя сфера в зависимости от прочности также способна диссоциировать на комплексообразователь и лиганды:
[Fe(Н2О)6]2+ ↔ Fe2+ + 6 Н2О – это вторичная диссоциация. Она
аналогична диссоциации слабых электролитов и характеризуется
константой равновесия: Крав. =
константа равновесия может служить мерой прочности комплекса: чем менее стоек комплекс, тем больше концентрация простых ионов или молекул Fe2+ и Н2О, тем больше численное значение константы. Поэтому константу равновесия,называют константой нестойкости комплекса. Величина, обратная константе нестойкости, называется
константой устойчивости:

25. Биологическая роль КС в организме.
Комплексообразование имеет большое значение для многих биологических процессов. В виде аквакомплексов находятся в крови, лимфе и тканевых жидкостях ионы щелочных и щелочноземельных металлов, выполняющих в организме важные и многообразные физиологические функции. Ионы d – элементов в результате высокой комплексообразующей способности находятся в организме исключительно в виде комплексов с белками и входят в состав гормонов, ферментов, витаминов и других жизненно важных соединений. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов - например витамин В12 , участвующий в процессах кроветворения, является комплексом кобальта.
Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, входящие в состав дыхательного фермента цитохромоксидазы, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять
транспорт кислорода.
В медицинской практике при лечении многих заболеваний в качестве
лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути и др.
Термодинамика
26.Термодинамическая система представляет изолированную часть пространства, содержащую тело или совокупность тел с большим числом частиц, для которой возможен массо- и теплообмен. Однофазная система
называется гомогенной, многофазная – гетерогенной.
Реакции, протекающие во всём объёме гомогенной системы, называются гомогенными реакциями, протекающие на границе раздела фаз – гетерогенными. Например, гомогенная реакция Н2(г) + N2(г) → продукты реакции, а реакция С(т) + О2(г) → продукты реакции является гетерогенной (окисление углерода идёт на поверхности соприкасающихся фаз – твёрдой и газообразной). Кроме того, в термодинамике ещё классифицируют системы и так:
Открытой системой является такая, для которой возможен обмен с внешней средой веществами (массой) и энергией;
Закрытой системой называется такая, для которой невозможен обмен с внешней средой веществом (массой), но возможен обмен энергией;
Изолированной системой является такая, для которой невозможен обмен ни веществом, ни энергией.
Термодинамическая система – это тело или группа тел,
взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
27. Параметры состояния т\д системы. Интенсивные и экстенсивные параметры. Примеры.
Состояние системы определяется совокупностью всех её физических и химических свойств. Изменение любого из этих свойств означает изменение состояния системы. Эти свойства называются термодинамическими параметрами состояния или функциями состояния. Чтобы можно было пользоваться функциями состояния необходимо точно обозначить сами состояния. Для этого служат переменные, называемые параметрами состояния. Ими, в частности, являются температура (Т), давление(Р), объём (V). Эти параметры связаны между собой математическими соотношениями, которые называются уравнениями состояния. Например, давление, объём и температура идеального газа связаны между собой следующим уравнением состояния: pV = nRT ;где n – число молей газа. Давление, объём и температура являются параметрами состояния, т.е. функциями состояния.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.). Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при
объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение). Параметры состояния связаны уравнением состояния.
28.Первый закон термодинамики (первое начало термодинамики):в любом процессе приращение внутренней энергии системы равно теплоте, полученной системой, минус работа, совершенная системой (или плюс работа, совершенная над системой).
∆U=Q-A
∆U - внутренняя энергия, Q – теплота, A - работа
Теплота, полученная системой, и работа, совершенная системой, считаются положительными. Теплота, отданная системой, и работа, совершенная над системой со стороны окружающей среды, считаются отрицательными. На основе 1 закона термодинамики, являющегося фундаментальным законом природы, простыми расчетами получают ценные сведения о процессах обмена веществ и энергии в организме.
Внутренней энергией тела является энергия, обусловленная движением составляющих его атомов и молекул. Абсолютное значение U определить невозможно. Поэтому определяют изменение внутренней энергии (∆U) при переходе из одного состояния (1) в другое (2): ∆U = U2 – U1. Внутренняя энергия

зависит как от природы и количества рассматриваемого вещества, так и от условий его существования. При одинаковых условиях количество внутренней энергии прямо пропорционально количеству вещества.
Энергия передаётся от одной системы (тела) к другой системе (телу) в форме работы и теплоты.
29. Энтальпия – это функция состояния, приращение которой равно тепловому эффекту процесса,протекающего при постоянном давлении. H [ Дж/моль ]
Тепловой эффект химической реакции — изменение внутренней энергии или энтальпии системы вследствие протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции (стехиометрии реакции) при следующих условиях:
●единственно возможной работой при этом является работа против внешнего давления,
●как исходные вещества, так и продукты реакции имеют одинаковую температуру
Способы расчета стандартной энтальпии химической реакции
1)По стандартным энтальпиям (теплотам) образования веществ
Стандартная теплота образования
вещества – это тепловой эффект реакции
образования 1 моль химического соединения из
простых веществ в стандартных условиях:
Т=298 К, Р=1 атм=101325 Па.
Теплоты |
образования |
простых |
веществ равны |
нулю. |
|
νi, νj – стехиометрические коэффициенты
соответствующими веществами в
уравнении реакции.
2)По стандартным энтальпиям (теплотам) сгорания веществ
Стандартная теплота сгорания вещества –
это тепловой эффект реакции полного сгорания 1 моль химического соединения в
стандартных условиях.
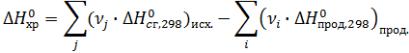
Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю.
Закон Гесса: теплота химической реакции, протекающей при постоянном
давлении или объѐме зависит только
от начального и конечного состояний
системы.
1 следствие.
Тепловой эффект химической реакции при стандартных уловиях равен сумме стандартных теплот образования продуктов реакции, умноженных на стехиометрические коэффициенты, минус теплоты образования исходных веществ, умноженные на стехиометрические коэффициенты.
Теплотой образования ∆Нf (индекс f от английского formation – образование) данного вещества называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ. Например:
С+ О2 = СО2 - ∆Нf(СО2),
С+ 1/2О2 = СО - ∆Нf(СО),
Н2 + 1/2О2 = Н2О - ∆Нf(Н2О)
Теплоты образования простых веществ равны нулю.
2 следствие.
Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных теплот сгорания исходных веществ, умноженных на стехиометрические коэффициенты, минус теплоты сгорания продуктов реакции, умноженные на стехиометрические коэффициенты.
Теплотой сгорания ∆Нсгор называется тепловой эффект реакции сгорания 1 моля вещества с образованием СО2, Н2О,
N2.
Например:
С2Н5ОН + 3О2 = 2СО2 + 3 Н2О
∆Нсгор(С2Н5ОН)
Таким образом, располагая табличными данными и пользуясь одним из следствий из закона Гесса, можно рассчитать тепловой эффект любой реакции при 298 К.
