
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / 3_Микробный_фактор_и_инфекционный_процесс
.pdf
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЗАНЯТИЮ
1.Иммунная система организма человека и ее основные функции. Роль АПК, Т- и B-лимфоцитов.
Иммунная система организма человека представляет совокупность лимфоидных органов и тканей, предназначенных для распознавания, уничтожения и элиминации (удаления) из организма генетически чужеродных веществ (антигенов). В иммунной системе различают центральные (костный мозг и тимус (вилочковая железа)) и периферические органы (лимфатические узлы, селезѐнка, лимфоидная ткань ротоглотки и кишечника).
В центральных органах иммунной системы происходит созревание и дифференцировка лимфоцитов, в результате чего они приобретают иммунокомпетентность, т.е. способность реагировать на чужеродные вещества. В периферических органах зрелые лимфоциты распознают и обезвреживают антигены.
Основные клетки, участвующие в адаптивном иммунном ответе: анти-
генпрезентирующие клетки (дендритные клетки, макрофаги и др.), Т- и В- лимфоциты.
Антигенпрезентирующие клетки (АПК) захватывают микробный анти-
ген, расщепляют (процессируют) его и затем представляют (презентируют) Т-лимфоцитам. Антигенпрезентирующей является любая клетка организма, несущая на своей поверхности молекулы главного комплекса гистосовме-
стимости I класса (МНСI – major histocompatibility complex (англ.)). Среди АПК существуют так называемые «профессиональные» АПК – три типа клеток, которые, кроме МНСI, несут на своей поверхности молекулы главного комплекса гистосовместимости II класса (МНСII). Такими «профессионалами» презентации являются дендритные клетки, макрофаги и В- лимфоциты.
Т-лимфоциты имеют на поверхности специфические антигенраспознающие рецепторы – TCR (T-cell receptor (англ.)). Кроме TCR, в процессе распознавания микробного антигена также участвуют маркерные рецепторы CD, характер которых зависит от функций Т-лимфоцитов.
CD-молекулы (антигены) располагаются на поверхности клеток иммунной системы и имеют различное функциональное значение. Их используют для идентификации и дифференцировки субпопуляций лейкоцитов (clasters of differentiation – кластеры (группы) дифференцировки). CD-антигены являются рецепторами для взаимодействия между клетками. Эти белковые рецепторы имеют порядковые номера и их присутствие на клетках зависит от функции Т- и В- лимфоцитов.
На основании различий в характеристике CD-маркеров, Т-лимфоциты подразделяют на CD4+ и CD8+:
CD4 Т-лимфоциты: к ним относят Т-хелперы активаторы и регуляторные Т-хелперы.
31

-Т-хелперы (Th, Th1, Th2) – при взаимодействии с АПК специфически распознают микробные антигены с помощью TCR. Одновременно CD4маркерные рецепторы связываются с МНСII для стабилизации взаимодействия Th и АПК. После распознавания антигена Th2 стимулируют иммунный ответ по гуморальному типу, а Th1 – по клеточному типу;
-Т-регуляторы – регулируют интенсивность иммунного ответа, подавляя активность других субпопуляций лимфоцитов.
CD8 Т-лимфоциты: к ним относят цитотоксические Т-лимфоциты (ЦТЛ). С помощью TCR они распознают антиген, а их CD8-рецепторы связываются с МНСI.
ЦТЛ лизируют клетки организма, зараженные вирусами или бактериями, а также опухолевые клетки. Следовательно, CD8 Т-лимфоциты отвечают за
клеточный иммунный ответ.
В-лимфоциты имеют на своей поверхности антигенраспознающий рецептор – ВCR (B-cell receptor (англ.)), а также маркерные рецепторы CD19-21 и др. После встречи с антигеном активированные В-лимфоциты превращаются в плазматические клетки (плазмоциты), вырабатывающие антитела – Ig
всех классов. Следовательно, В-лимфоциты отвечают за гуморальный
иммунный ответ.
Цитокины – гуморальные факторы системы иммунитета белковой природы. Синтезируются различными клетками организма и регулируют межклеточное взаимодействие. Цитокины, которые синтезируются при иммунном ответе, называются интерлейкинами (ИЛ). Они имеют порядковые номера. Основная функция ИЛ – стимуляция клеток, участвующих в иммунном ответе.
Весь процесс возникновения защитных механизмов организма состоит из трех действий: 1) распознавание чужеродного микроба специфическими иммунными клетками, 2) активация этих клеток для получения специфического ответа и 3) возникновение реакций, которые ведут к уничтожению конкретных чужеродных микробов.
Независимо от того, какой чужеродный микроб проник в организм, защищать его будут оба звена адаптивного иммунитета: гуморальный (опосредованный антителами) и клеточный.
2. Иммунный ответ по гуморальному и клеточному типу. Иммунологическая память.
Иммунный ответ по гуморальному типу. Для его осуществления необхо-
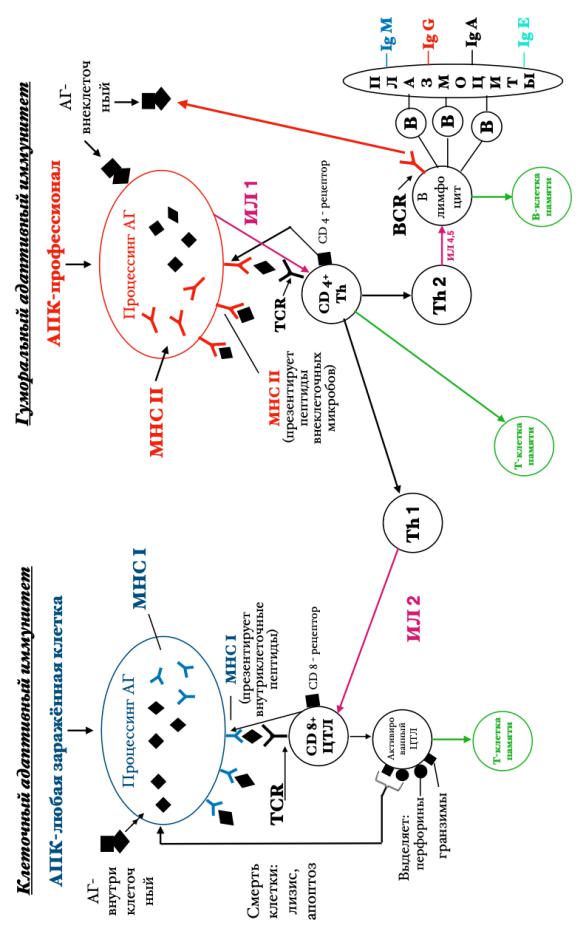
димо взаимодействие (кооперация) антигенпрезентирующей клетки – профессиональной АПК, Т-хелперов второго порядка (Th2) и В-лимфоцитов. Этот процесс происходит в несколько стадий (рис.10):
32
33
После появления в организме микробного антигена, профессиональные АПК (дендритная клетка или макрофаг, а также В-лимфоцит) захватывает антиген и расщепляет его на отдельные антигенные детерминанты (пептиды). Это расщепление обозначается как процессирование. Процессированный антиген соединяется с MHCII и в таком комплексе выходит на поверхность АПК. Комплекс [Аг+МНСII] передается на рецепторы Th (TCR и CD4+). Одновременно АПК выделяет ИЛ-1. Th активируется и дает популяцию двух типов Th: Th1 (участвует в стимуляции иммунного ответа по клеточному типу) и Th2. Th2 активирует В-лимфоцит с помощью ИЛ-4,5. Кроме того, В-лимфоцит самостоятельно с помощью рецептора BCR распознает микробный антиген. Активированные В-лимфоциты трансформируются в плазмоциты, продуцирующие антитела (Ig) различных классов.
Иммунный ответ по клеточному типу – предназначен для уничтожения клеток организма, инфицированных вирусами или бактериями, а также опухолевых клеток. Процесс происходит в несколько стадий (рис 10): зараженная клетка (АПК) расщепляет микроб на отдельные антигенные детерминанты (пептиды). Процессированный Аг соединяется с МНСI и в таком комплексе выходит на поверхность АПК. Комплекс [Аг+МНСI] передается на рецепторы ЦТЛ (TCR и CD8+). Одновременно на ЦТЛ поступает от Th1 ИЛ-2. ЦТЛ активируется и выделяет цитотоксические белки (перфорины и гранзимы). Их действие приводит к гибели зараженной клетки.
Перфориновый и гранзимный механизмы гибели клетки-мишени.
Перфорины на поверхности клетки-мишени формируют трансмембранные поры диаметром 5-20 нм. Через них в клетку проникает вода, что приводит к ее осмотической смерти. Через поры в клетку-мишень поступают гранзимы – протеазы, запускающие ее апоптоз путем фрагментации ДНК клетки. Зараженная клетка погибает.
Иммунологическая память основана на наличии Т- и В-лимфоцитов иммунологической памяти, которые образуются при первичной встрече с антигеном в организме (первичном иммунном ответе). Иммунологическая память – это способность лимфоцитов сохранять информацию об антигене и отвечать усиленной и ускоренной иммунологической реакцией на повторную встречу с гомологичным антигеном. В частности, при вторичном иммунном ответе за счет лимфоцитов памяти значительно возрастает скорость образования и количество IgG. Так как клетки памяти живут в течение многих лет и способны к самовоспроизведению, иммунологическая память сохраняется годами, а при некоторых инфекциях (корь, натуральная оспа и др.) – пожизненно.
Знания о наличии иммунологической памяти и ее способности ускорять и усиливать защиту организма при повторной встрече с антигеном легли в основу разработки правил доз и интервалов вакцинации при иммунизации детских контингентов согласно Национальному календарю прививок.
34
3. Аллергия. Классификация аллергических реакций по времени проявления симптомов.
Аллергия («allos» – иной, «ergos» – действие (греч.)) – иммунологическая реакция, которая проявляется повышенной чувствительностью организма в ответ на повторное, а иногда и первичное воздействие аллергена (антигена).
Аллерген – вещество белковой или небелковой природы, способное вызывать состояние сенсибилизации – повышенной чувствительности организма. Первая (первичная) доза аллергена, повышающая чувствительность, называется сенсибилизирующей. Вторая (повторная) доза аллергена, вызывающая ответную реакцию организма, называется разрешающей.
По происхождению аллергены разделяют на неинфекционные и инфекционные аллергены.
Инфекционную аллергию могут вызывать различные микроорганизмы: бактерии, микроскопические грибы и вирусы.
По времени проявления симптомов выделяют два типа аллергических реакций:
ГНТ – гиперчувствительность немедленного типа. Одним из вариантов ГНТ является анафилаксия. Происходит при участии IgЕ.
ГЗТ – гиперчувствительность замедленного типа, клеточно-
опосредованная реакция. Одним из вариантов ГЗТ является инфекционная аллергия. Происходит при участии Т-лимфоцитов.
4. Анафилаксия. Анафилактический шок. Специфическая десенсибилизация организма.
Анафилаксия (ana – без, phylaxe – защита (греч.)) – гиперчувствительность немедленного типа, проявляется через несколько секунд или минут после повторного введения чужеродного белка. Анафилаксия может проявляться в виде системной генерализованной реакции – анафилактического шока. Эта реакция может возникать в ответ на введение антибиотиков (пенициллина и др.), обезболивающих препаратов, а также лечебных сывороток, полученных из крови иммунизированных лошадей (противодифтерийная, противостолбнячная, противоботулиническая и др.).
Первый контакт человека с аллергеном сенсибилизирует организм, т.е. вызывает образование антител, а при последующих контактах происходит аллергический ответ.
Механизм развития анафилактического шока (рис.11).
После попадания сенсибилизирующей (первичной) дозы аллергена (антигена) в организме вырабатываются IgЕ (реагины). Эти антитела прикрепляются к мембранам тучных клеток и базофилов. Данные клетки имеют большое количество гранул, содержащих различные биологически активные медиаторы.
35
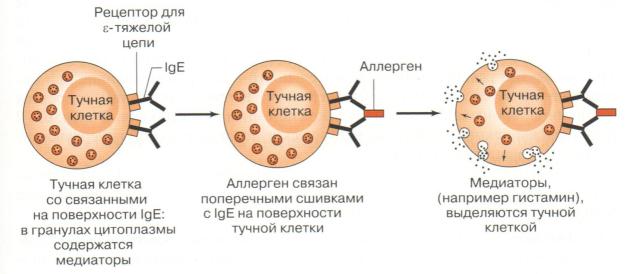
Описанные события не сопровождаются какой-либо симптоматикой до тех пор, пока тот же аллерген не попадет в организм повторно (разрешающая доза). При этом на тучных клетках и базофилах образуется большое количество комплексов [аллерген (Аг)+IgЕ], что приводит к залповому выбросу из гранул тучных клеток гистамина, гепарина и других медиаторов. Свободные медиаторы попадают в кровь и вызывают немедленную реакцию: расширение сосудов брюшной полости, спазм гладкой мускулатуры бронхов и внутренних органов.
Рисунок 11 – Механизм развития анафилактического шока
Основные симптомы анафилактического шока: резкое падение кровя-
ного давления, частый нитевидный пульс, бронхоспазм, одышка, потеря сознания. Если больному своевременно не оказать врачебной помощи, анафилактический шок может закончиться летальным исходом.
Для предотвращения развития анафилактического шока при использо-
вании лошадиных лечебных сывороток отечественный иммунолог М.М. Безредка предложил особый метод введения этих препаратов, получивший название «специфическая десенсибилизация». Метод заключается в дробном (мелкими дозами) введении этих препаратов. Комплексы [Аг+IgЕ] образуются в небольших количествах и выделяющихся медиаторов не хватает, чтобы вызвать системную шоковую реакцию.
Перед введением лечебной дозы сыворотки определяют наличие или отсутствие гиперчувствительности постановкой внутрикожной пробы с 0,1 мл разведенной сыворотки. При отрицательной реакции вводят 0,1 мл неразведенной сыворотки, при отсутствии аллергических явлений через 30 минут – остальную дозу. При наличии гиперчувствительности (положительная внутрикожная проба – покраснение и отек в месте введения) вначале дробно вводят разведенную сыворотку, а потом дробно – неразведенную (по схеме).
При возникшей симптоматике анафилактического шока немедленно проводится лечение согласно «Стандарту скорой медицинской помощи при анафилактическом шоке».
36
5. Инфекционная аллергия. Практическое применение кожных аллергических проб для диагностики инфекционных заболеваний.
Инфекционная аллергия относится к гиперчувствительности замедленного типа, которая развивается в ответ на внедрение микроорганизмов и появление в организме микробных аллергенов (антигенов).
Инфекционная аллергия обусловлена взаимодействием микробных аллергенов с макрофагами и Т-хелперами первого порядка (Th1), стимулирующими клеточный иммунитет.
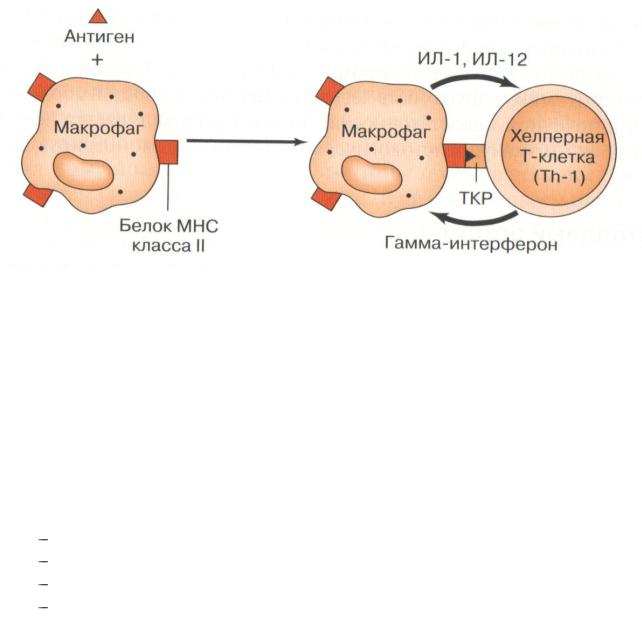
Механизм развития инфекционной аллергии:
АПК (макрофаг) поглощает аллерген, процессирует его и презентирует на поверхности в комплексе с МНСII. Th1 распознает этот комплекс с помощью TCR-рецептора и выделяет гамма-интерферон, который активирует макрофаги. Они продуцируют цитокины, повреждающие ткани, в которых находится аллерген, и фагоцитируют клетки, содержащие аллерген (рис. 12).
Рисунок 12 – Механизм развития инфекционной аллергии
Инфекционная аллергия наблюдается при хронических бактериальных
игрибковых заболеваниях. Специфичность инфекционной аллергии дает возможность использовать кожно-аллергические пробы с аллергенами возбудителей для диагностики конкретных заболеваний.
Пробы с аллергенами проводят внутрикожно. При положительной реакции через 24-48 часов на месте введения аллергена появляются инфильтрат (папула)
ипокраснение. При отрицательной реакции эти признаки отсутствуют.
Кожно-аллергические пробы используют для диагностики:
туберкулеза (проба Манту с туберкулином); бруцеллеза (проба Бюрне с бруцеллином); туляремии (проба с тулярином); сибирской язвы (проба с антраксином) и др.
37
6. Иммунопрофилактика и иммунотерапия инфекционных заболеваний. Препараты для активной иммунизации. Виды вакцин.
Иммунопрофилактика – введение иммунных препаратов с целью предотвращения развития инфекционных заболеваний.
К профилактическим препаратам относят:
Вакцины (vacca (франц.) – корова), используемые в большинстве случаев для массовой активной профилактики среди детских контингентов;
Сывороточные препараты – для экстренной пассивной профилактики
некоторых инфекционных заболеваний, в случаях контакта людей с инфекционными больными (корь, вирусный гепатит А и др.).
Иммунотерапия – введение иммунных препаратов (в основном – сывороточных, реже – вакцин) для лечения инфекционных заболеваний.
Для создания искусственного активного противоинфекционного иммунитета используют вакцины, которые получают из микробов и продуктов их жизнедеятельности. На введение микробных антигенов в организме образуются антитела и другие факторы иммунитета.
Виды вакцин:
1. Корпускулярные: из бактериальных клеток или вирусных частиц. К корпускулярным вакцинам относят живые и инактивированные (убитые) вакцины:
 живые вакцины из аттенуированных штаммов патогенных микробов, утративших вирулентные свойства, но сохранивших иммуногенность.
живые вакцины из аттенуированных штаммов патогенных микробов, утративших вирулентные свойства, но сохранивших иммуногенность.
Аттенуация (ослабление патогенных свойств) достигается путем дли-
тельного воздействия на возбудителя физических, химических или биологических факторов (вакцина БЦЖ для профилактики туберкулеза, тривакцина против кори, эпидемического паротита и краснухи и др.);
 инактивированные (убитые) вакцины из патогенных микробов, инактивированных с помощью физических или химических факторов. Их используют как для профилактики (коклюшная, полиомиелитная), так и иммунотерапии инфекционных болезней (бруцеллезная, герпетическая
инактивированные (убитые) вакцины из патогенных микробов, инактивированных с помощью физических или химических факторов. Их используют как для профилактики (коклюшная, полиомиелитная), так и иммунотерапии инфекционных болезней (бруцеллезная, герпетическая
идр.).
2.Химические вакцины (из протективных антигенов микробов, вызывают полноценный иммунный ответ, который защищает организм от возбудителя инфекции):
 бактериальные (пневмококковая и менингококковая вакцины из капсульных полисахаридов микробов, бесклеточная коклюшная вакцина);
бактериальные (пневмококковая и менингококковая вакцины из капсульных полисахаридов микробов, бесклеточная коклюшная вакцина);  вирусные (гриппозная вакцина из протективных антигенов (гемагглютинин и нейраминидаза) вируса гриппа).
вирусные (гриппозная вакцина из протективных антигенов (гемагглютинин и нейраминидаза) вируса гриппа).
38
3.Анатоксины, которые получают из экзотоксинов возбудителей путем длительной обработки их раствором формалина. Анатоксины лишены токсических свойств, но сохранили иммуногенность, т.е. способность вызывать в организме выработку антитоксических антител, нейтрализующих экзотоксины возбудителей (например: дифтерийный, столбнячный анатоксины). Для усиления иммуногенных свойств анатоксины адсорбируют на адъюванте (гидроокись алюминия).
4.Генно-инженерные вакцины:
 молекулярные (рекомбинантные) вакцины – получают путем введения в дрожжевые или бактериальные клетки плазмиды, кодирующей синтез протективного антигена определенного возбудителя. После этого дрожжевые клетки выращивают на питательной среде, где они в процессе размножения вырабатывают протективные антигены возбудителя. Препарат очищают от дрожжевых белков и используют для иммунизации (рекомбинантная дрожжевая вакцина против вирусного гепатита В из протективного HBs-антигена вируса);
молекулярные (рекомбинантные) вакцины – получают путем введения в дрожжевые или бактериальные клетки плазмиды, кодирующей синтез протективного антигена определенного возбудителя. После этого дрожжевые клетки выращивают на питательной среде, где они в процессе размножения вырабатывают протективные антигены возбудителя. Препарат очищают от дрожжевых белков и используют для иммунизации (рекомбинантная дрожжевая вакцина против вирусного гепатита В из протективного HBs-антигена вируса);
 векторные вакцины – для их приготовления используют непатогенный для человека вирус (иначе вирус-вектор). В его ДНК встраивают гены, кодирующие синтез протективных антигенов другого патогенного вируса. В организме живой векторный вирус размножается и вырабатывает не только свои антигены, но и протективные антигены возбудителя (векторная вакцина для профилактики бешенства среди диких животных, вакцина «Спутник V» имеет в качестве вектора аденовирус, «CanSino», Китай, «AstraZeneca», Великобритания-Швеция).
векторные вакцины – для их приготовления используют непатогенный для человека вирус (иначе вирус-вектор). В его ДНК встраивают гены, кодирующие синтез протективных антигенов другого патогенного вируса. В организме живой векторный вирус размножается и вырабатывает не только свои антигены, но и протективные антигены возбудителя (векторная вакцина для профилактики бешенства среди диких животных, вакцина «Спутник V» имеет в качестве вектора аденовирус, «CanSino», Китай, «AstraZeneca», Великобритания-Швеция).
5.Синтетические вакцины – для их получения используют эпитопы (антигенные детерминанты микробов), которые соединяют с полимерным крупномолекулярным носителем. В качестве носителя используют иммуномодулятор (полиоксидоний), который обеспечивает многократное усиление иммунного ответа на данные антигенные детерминанты (гриппозная вакцина с полиоксидонием).
6.РНК-вакцины – действующая часть которых РНК, кодирующая белок, характерный для патогена. Помимо РНК, в вакцине присутствует липидная оболочка, защищающая РНК от разрушения и обеспечивающая ее проникновение в клетку. мРНК вакцины (Pfizer/BionTech, Moderna) имитируют поведение вируса. Только вместо целой вирусной частицы в клетку попадает тот фрагмент РНК, который несет информацию о белке-шипе SARS-COV-2. Этот фрагмент служит матрицей для синтеза. Отсюда название – матричная или мРНК.
Вакцины по составу:
 моновакцины создают иммунитет к одному возбудителю (например: чумная вакцина, вакцина против гепатита А);
моновакцины создают иммунитет к одному возбудителю (например: чумная вакцина, вакцина против гепатита А);
39
 ассоциированные вакцины создают одновременно иммунитет к нескольким возбудителям (например: адсорбированная коклюшно-дифтерийно- столбнячная вакцина (АКДС-вакцина, состоящая из инактивированной корпускулярной коклюшной вакцины в ассоциации с дифтерийным и столбнячным анатоксинами), адсорбированный дифтерийно-столбнячный анатоксин (АДС-анатоксин, используют для профилактики дифтерии и столбняка), живая тривакцина (используют для профилактики кори, эпидемического паротита и краснухи)).
ассоциированные вакцины создают одновременно иммунитет к нескольким возбудителям (например: адсорбированная коклюшно-дифтерийно- столбнячная вакцина (АКДС-вакцина, состоящая из инактивированной корпускулярной коклюшной вакцины в ассоциации с дифтерийным и столбнячным анатоксинами), адсорбированный дифтерийно-столбнячный анатоксин (АДС-анатоксин, используют для профилактики дифтерии и столбняка), живая тривакцина (используют для профилактики кори, эпидемического паротита и краснухи)).
Практическое применение вакцин:
1. Для профилактики инфекционных заболеваний (большинство вакцин):
 для обязательной плановой профилактики среди детей согласно национальному календарю прививок (туберкулезная вакцина БЦЖ, вакцина против гепатита В, вакцина АКДС, полиомиелитная вакцина, тривакцина против кори, эпидемического паротита и краснухи);
для обязательной плановой профилактики среди детей согласно национальному календарю прививок (туберкулезная вакцина БЦЖ, вакцина против гепатита В, вакцина АКДС, полиомиелитная вакцина, тривакцина против кори, эпидемического паротита и краснухи);
 для профилактики заболеваний среди людей из групп риска, а
для профилактики заболеваний среди людей из групп риска, а
именно медицинских работников (вакцина против гепатита В) и животноводов (бруцеллезная и сибиреязвенная вакцины).
2. Для лечения (иммунотерапия) в основном хронических инфекционных заболеваний. С этой целью используют убитые вакцины (бруцеллезная, герпетическая и др.), а также анатоксины (стафилококковый анатоксин).
7. Серотерапия и серопрофилактика инфекционных заболеваний. Виды сывороточных препаратов.
Сывороточные препараты содержат специфические антитела и создают в организме приобретенный искусственный пассивный иммунитет. Эти препараты используют для лечения (серотерапия), а также экстренной профилактики с целью быстрого создания иммунитета у инфицированных людей, имевших контакт с больными.
Сывороточные препараты по технологии получения бывают двух ви-
дов:
Иммунные сыворотки получают из крови иммунизированных животных, обычно лошадей. Это гетерологичные (чужеродные) сыворотки, т.к. содержат чужеродные для человека сывороточные белки (противостолбнячная антитоксическая сыворотка, противоботулиническая антитоксическая сыворотка, противодифтерийная антитоксическая сыворотка).
Иммуноглобулины получают из иммунных сывороток путем фракционирования и осаждения. Они более концентрированы, не содержат балластных компонентов и представлены фракцией IgG. Иммуноглобулины бывают как гетерологичные (иммуноглобулин противосибиреязвенный лошадиный и др.), так и гомологичные, получаемые из крови иммунизированных людей (доноров) – иммуноглобулин противостолбнячный и др.
40
