
- •Методические указания к лабораторно – практическому занятию
- •1) Химическое равновесие.
- •2) Обратимые и необратимые по направлению реакции.
- •3) Термодинамические условия равновесия в изолированных и закрытых системах.
- •4) Константа химического равновесия.
- •5) Уравнения изотермы и изобары химической реакции.
- •Методические указания к лабораторно – практическому занятию
- •Гомогенный катализ
- •Ферментативный катализ

изменяться, например, уменьшатся размеры зерен твердого катализатора,
изменится структура поверхностных слоев;
2)катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени;
3)действие катализатора является специфичным (селективным);
4)катализатор увеличивает скорость реакции за счет уменьшения Еакт,
ведет реакцию по пути с меньшим энергетическим барьером.
Гомогенный катализ
Рассмотрим схему реакции, протекающей без катализатора:
A + B → AB* →C + D.
В присутствии катализатора реакция протекает в несколько стадий:
1. |
A |
|
k |
|
|
|
1 |
|
|
+ K |
→ |
= AK |
|
|
|||
|
|
||
|
k |
|
|
|
2 |
|
2. |
AK |
k |
* |
3 |
|
+ B → ABK |
|
3. |
ABK |
* |
k4 |
|
→C + D + K |
При условии k3>>k1 скорость образования продуктов можно выразить через концентрации реагентов и катализатора:
|
dc |
C |
|
k k |
3 |
c |
A |
c |
B |
|
|||
w = |
|
= |
|
1 |
|
|
|
c |
|||||
|
dt |
|
k |
|
+ k |
|
c |
|
K |
||||
|
|
2 |
3 |
B |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Это уравнение лежит в основе кинетики гомогенных каталитических реакций. Из уравнения видно, что скорость процесса прямо пропорциональна концентрации катализатора,
исключение составляют лишь случаи, когда катализатор находится в большом избытке, в
результате чего скорость процесса лимитируется не кинетическими, а физическими закономерностями, например, диффузией растворенного вещества к катализатору.
Энергетический профиль каталитической реакции представлен на
рисунке 4.
23
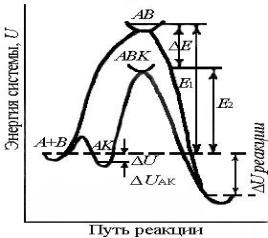
Рис.4. Энергетические профили реакций с катализатором и без него.
Е1 – энергия активации некаталитической реакции,
Е2 – каталитической реакции
В ранних исследованиях предполагалось, что поверхность катализатора энергетически однородна (Лэнгмюр). В дальнейшем была экспериментально доказана адсорбционная неоднородность поверхности. Возникло представление о том, что каталитически активны только определенные участки поверхности, на которых имеются адсорбционные центры. Здесь вещество способно образовать активное для протекания данного каталитического процесса промежуточное поверхностное соединения,
благодаря чему понижается энергия активации реакции.
Гетерогенный катализ
В случае гетерогенного катализа реакции происходят на границе раздела
фаз.
Гетерогенный катализ состоит из следующих стадий:
1.массоперенос реагентов к катализатору;
2.абсорбция – образование абсорбированного комплекса между реагентом и катализатором;
3.каталитическая реакция – образование продукта в основном адсорбированном состоянии;
4.десорбция продукта;
5.внутренний массоперенос (изнутри катализатора);
24
6. внешний массоперенос (из области реакции).
Общая скорость каталитической реакции определяется скоростью самой медленной из этих стадий. Если не рассматривать диффузию и считать, что равновесие «адсорбция ↔ десорбция» устанавливается быстро, то скорость каталитической реакции определяется скоростью реакции в адсорбционном слое, где роль реагента играют свободные адсорбционные центры. Простейший механизм гетерогенного катализа описывается схемой:
kадс
→ k
S газ Sадс →1 Pадс . kдес
Для придания катализаторам большей избирательности, термической стойкости,
механической прочности и активности их часто применяют в форме многокомпонентных систем:
смешанных, на носителях, промотированных катализаторов.
Промоторы - это вещества, которые не обладают каталитическими свойствами, но добавление их к катализатору значительно увеличивает его активность.
Каталитические яды - это вещества, понижающие активность катализатора.
Активность катализаторов оценивают либо количеством вещества (в молях), реагирующих в единицу времени под воздействием единицы массы катализатора, или количеством вещества (в
молях), реагирующих в единицу времени под воздействием единицы поверхности катализатора.
Ферментативный катализ
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами биологического происхождения. Это белковые молекулы, называемые
ферментами или энзимами.
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин,
панкреатин). При ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты,
25
приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений. Для лечения инфекционных заболеваний используются препараты лизоцина, которые разрушают оболочку некоторых болезнетворных бактерий. Очень важные ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов) – плазмин, трипсин,
химотрипсин, на их основе с разными добавками созданы различные лекарственные препараты – стрептокиназа, стрептаза, и т.п., широко применяемые в медицине.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1)высокая специфичность;
2)эффективность действия;
3)биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента.
Простейшая схема ферментативного катализа включает обратимое образование промежуточного комплекса фермента (Е) с реагирующим веществом (субстратом S) и разрушение этого комплекса с образованием продуктов реакции (Р):
26

|
k1 |
|
|
→ |
k3 |
E + S |
ES → E + P . |
|
|
k2 |
|
При условии, что k3>>k1 , с учетом уравнения материального баланса
[E]=[E0]-[ES] (индекс «0» означает начальную концентрацию) получаем
уравнение Михаэлиса-Ментен. В уравнении скорость образования продукта выражена через начальную концентрацию фермента и текущую концентрацию субстрата:
|
|
|
|
|
w = |
d P |
= |
w |
max |
S |
, |
||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
dt |
K |
|
|
+ S |
||||
|
|
|
|
|
|
|
M |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
где wmax=k2[E0] – максимальная скорость реакции; |
|
||||||||||||
K M = |
k |
3 |
+ k |
2 |
- это константа Михаэлиса. |
|
|||||||
|
|
|
|||||||||||
|
|
k |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
Анализ уравнения Михаэлиса-Ментен
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной скорости. Она характеризует специфичность фермента по отношению к субстрату (чем меньше, тем специфичнее). Типичные значения KM от 10-6 до 10-1 моль/л.
Константу скорости k3 иногда называют числом оборотов фермента.
Число оборотов фермента - число молекул субстрата, которые превращаются на активном центре фермента в единицу времени (обычно от 10 до 108 мин-1).
Уравнение Михаэлса можно записать в линейных координатах:
1 |
1 |
|
K M 1 |
||||
|
= |
|
+ |
|
|
|
. |
w |
wmax |
wmax |
[S] |
||||
27
Для определения параметров уравнения KM и wmax проводят серию измерений начальной скорости реакции от начальной концентрации субстрата и представляют экспериментальные данные в координатах 1/w0 – 1/[S0].
Течение химических реакций может быть заторможено присутствием некоторых веществ. Ингибиторы ферментативного катализа, способны образовывать комплексы с ферментом или фермент-субстратным комплексом.
Вопросы для самоконтроля
1.Что изучает химическая кинетика?
2.Что называется скоростью химической реакции?
3.Напишите выражение для средней скорости реакции. Как она определяется экспериментально?
4.Что собой представляет истинная скорость реакции?
5.По каким признакам классифицируют реакции в кинетике? Приведите эти классификации.
6.Дайте определения понятиям молекулярность, порядок реакции, период полупревращения.
7.Какие факторы влияют на скорость химической реакции?
8.Какова зависимость скорости реакции от концентрации. Сформулируйте основной постулат химической кинетики. Приведите его запись.
9.Что называют константой скорости химической реакции?
10.Запишите кинетические уравнения реакций нулевого, первого, второго порядков.
11.Опишите экспериментальные методы определения скорости и константы скорости реакций.
12.Каким образом увеличение температуры влияет на скорость химической реакции? Сформулируйте правило Вант-Гоффа.
13.Запишите уравнение Аррениуса.
14.Изобразите энергетический профиль реакций с различным тепловым
28
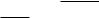
эффектом (энергетическая диаграмма для реакции, протекающей без тепловых эффектов; энергетическая диаграмма для экзотермической реакции, для эндотермической реакции).
15.Что такое энергия активации?
16.Опишите теорию активных соударений (ТАС).
17.Какова роль стерического фактора?
18.Опишите теорию переходного состояния.
19.Дайте определение понятию катализ (гомогенный и гетерогенный катализ). Изобразите энергетический профиль каталитической реакции. Какое влияние оказывает катализатор на выход продуктов реакции?
20.Каковы особенности каталитической активности ферментов? Запишите и
проанализируйте уравнение Михаэлиса - Ментен.
Ситуационные задачи
Задачи на правило Вант-Гоффа
|
|
T −T |
|
kT |
|
2 |
1 |
|
|
|
|
2 |
= |
10 |
|
kT |
|
||
|
|
|
|
1 |
|
|
|
Задача №1.
С помощью правила Вант-Гоффа вычислить при какой температуре реакция закончится через 15 минут, если при температуре 293 К реакция идёт в течение 2 часов. Температурный коэффициент Вант-Гоффа реакции равен 3. Константа скорости обратно пропорциональна времени.
Ответ: 312 К.
Задача №2.
Температурный коэффициент реакции равен 3,5. Константа скорости kI при температуре ТI=15°С равна 0,2 с-1. Найти kII при температуре TII=40°С. Ответ: 0,009 с-1.
Задачи на уравнение Аррениуса
29
k |
|
|
|
E |
a |
T − T |
|
|
|
|
E |
a |
T |
2 |
− T |
|
||||
ln |
|
2 |
|
= |
|
|
2 1 |
. |
ln k |
|
= ln k + |
|
|
|
1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
k |
|
|
R |
|
T T |
|
|
2 |
1 |
R |
|
T |
2 |
T |
|
||||
|
|
1 |
|
|
|
|
|
2 1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
R T |
T |
2 |
ln |
k2 |
|||
|
|
|
|
|||||
1 |
|
|
|
k1 |
|
|||
Ea = |
|
|
|
|
|
. |
||
T2 |
− T1 |
|
||||||
|
|
|
|
|||||
Задача №3.
Скорость бактериального гидролиза мышц рыб удваивается при переходе от Т1= -1,1°С до Т2= 2,2°С. Рассчитать энергию активации этой реакции.
Ответ: 130,6 кДж.
Задача №4.
Константа скорости гидролиза новокаина при Т=313 К равна 6,6∙10-7 с-1.
Энергия активации этой реакции 55,2 кДж/моль. Сколько процентов новокаина разложится при Т=293 К за 10 дней?
Ответ: 12,5%.
Задача №5.
Срок годности лекарственного препарата при 40°С составляет 1 год. Определить срок годности при температуре 20°С, если предположить, что разложение является реакцией первого порядка, а температурный коэффициент Вант-Гоффа равен 2.
Ответ: 4 года.
Задача №6.
Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике «ускоренного старения» при температурах 50 и 80°С. Рассчитаны следующие константы: k50=0,52∙10-3сут-1 k80=1∙10-3сут -1. Определите срок годности порошка при температуре 20°С.
Ответ: 342,8 суток.
Задачи для решения на занятии.
30
1) Константа скорости гидролиза новокаина при 313 К равна 0,66 мин-1,
энергия активации реакции равна 55,2 кДж/моль. Какая массовая доля (%)
новокаина разложится за 10 дней хранения при 193К?
2)Появление изотопа йода 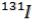 имеет место при авариях на АЭС. Период его полураспада 8 суток. За какое время этот изотоп распадается на 99% ?
имеет место при авариях на АЭС. Период его полураспада 8 суток. За какое время этот изотоп распадается на 99% ?
3)Во сколько раз увеличится скорость реакции взаимодействия водорода и кислорода 2H2 + O2 = 2H2O, если концентрации исходных веществ увеличить в два раза?
4)Константа скорости химической реакции при 200С равна 1 моль/(л∙сек).
Вычислите константу скорости при 600С, если температурный коэффициент реакции равен 3. По размерности Константы скорости определить порядок реакции.
5)Константа скорости распада радиоактивного вещества составляет 0, 00507 (день)−1. Определите по размерности константы скорости, порядок химической реакции и, воспользовавшись соответствующим кинетическим уравнением, определите время (в днях), в течение которого вещество расходуется на 90%.
6)Во сколько раз увеличится скорость реакции при увеличении температуры на 250С, если γ = 3?
31
7)Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
8)Константа скорости реакции при 300К равна 0,02, а при 350К равна 0,6. Определите энергию активации этой реакции?
9)Для реакции:
C5H5N + CH3I → [C5H5NCH3] I
При 315К k = 0,035 (моль /л)−1 мин−1 При 323К k = 0,059 (моль /л)−1 мин−1 Вычислите энергию активации?
10)Константа скорости необратимой реакции 1-го порядка равна k = 2,06 ∙10−3 мин−1. Определите, сколько % исходного вещества разложится за 25 минут?
11)Для реакции разложения N2 O5 при разных температурах получены следующие данные:
T0C |
45 |
65 |
kI, с-1 |
4, 98 ∙10-4 |
4,87 ∙ 10-3 |
Рассчитайте величину kI при t = 500С.
12) Константа скорости реакции |
|
|
При t1 = 9,40с |
k1 |
= 2,37; |
При t2 = 14,40С |
k2 |
= 3,204. |
Рассчитайте температурный коэффициент скорости реакции.
13) Для необратимой реакции 2-го порядка:
CH3COOC2H5 + CH3COONa + C2H5OH
KII = 5,4 (моль/л)-1 * мин-1. Исходные концентрации эфира и щелочи
32
одинаковы и равны 0,02 моль/л. Какова будет концентрация исходных веществ через 10 минут после начала опыта?
14)При хранении таблеток амидопирина было установлено, что при 80°С
и90°С константы скорости разложения соответственно равны 1,61∙10-6с-1, 4,2∙10-6с-1. Определите срок хранения таблеток (время разложения 10-ти % вещества) при 20°С.
15) Константа скорости химической реакции при 200С равна 1 моль/л∙сек. Вычислите константу скорости при 600С, если температурный коэффициент реакции равен 3. По размерности Константы скорости определить порядок реакции.
16) Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике «ускоренного старения» при температурах 50 и 80°С. Рассчитаны следующие константы: k50°С=5,2∙10-4 сут -1, k80°С. =1,0∙10-3 сут -1. Определите срок годности порошка при температуре
23°С.
17) Для реакции разложения N2O5 |
при разных температурах получены |
|
следующие данные: |
|
|
T0C |
45 |
65 |
kI, с-1 |
4, 98 ∙10-4 |
4,87 ∙ 10-3 |
Рассчитайте величину kI при t = 500С.
18)Константа скорости реакции при 300К равна 0,02, а при 350К равна 0,6. Определите энергию активации этой реакции?
19)Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
33
20) Для реакции:
C5H5N + CH3I → [C5H5NCH3] I
При 315К k = 0,035 (моль /л)−1 мин−1
При 323К k = 0,059 (моль /л)−1 мин−1
Вычислите энергию активации?
21) Константа скорости реакции |
|
при t1 = 9,40С |
k1 = 2,37; |
при t2 = 14,40С |
k2 = 3,204. |
Рассчитайте температурный коэффициент скорости реакции.
1)При температуре 0°С гранула железа растворяется в соляной кислоте за 20
минут. Если температурный коэффициент γ = 2, то такой же кусочек железа растворится при t=20°С за 5 минут.
2)Уравнение Аррениуса может быть записано в виде к=к0е-(Ea/RT).
34
