
- •5.Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
- •6.Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа хим.Равновесия. Прогнозирование смещения хим.Равновесия.
- •7.Классификация растворов: по степени дисперсности; по степени насыщенности. Коллигативные свойства растворов: закон Рауля, понижение t замерзания р-ра, повышение t кипения р-ра.
- •8.Классификация дисперсных систем: по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой.
- •10.Осмос, осмотическое давление, закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
- •11.Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
- •12.Факторы устойчивости коллоидных растворов. Механизм возникновения электрического заряда коллоидной частицы. Мицелла. Ядро. Гранула.
- •13.Ионное произведение воды. Методы определения рН растворов. Индикаторы.
- •14.Протолитические реакции. Понятия о кислотах и основаниях. Амфолиты. Ионизация слабых кислот и оснований. Константа кислотности и основности.
- •15.Буферные системы: определение, классификация, уравнение Гендерсона-Гассельбаха. Механизм действия буферных систем. Зона буферного действия и буферная емкость.
- •16.Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Взаимодействие буферных систем организма человека.
- •17.Понятие о кислотно-основном состоянии организма. Виды нарушения кос и способы коррекции.
- •18.Типы окислительно-восстановительных реакций, протекающих в организме.
- •19.Физико-химические принципы транспорта электронотранспортной цепи митохондрий.
- •20.Классификация комплексных соединений, их строение. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы ,кобаламины).
- •31.Изомерия моносахаридов: стереоизомерия, цикло-оксо-таутомерия, а- и в-аномерия на примере глюкозы.
- •34.Дисахариды: классификация (редуцируюище - мальтоза, целлобиоза, лактоза и нередуцирующие сахароза, трегалоза). Строение, химические свойства: гидролиз, окисление редуцирующих сахаров.
- •35.Классификация полисахаридов (гомо и гетерополисахариды ). Примеры.
- •36.Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, декстран, целлюлоза. Структура, типы химических связей, гидролиз.
- •37.Липиды: определение, классификация.
- •39. Простые (нейтральные) липиды - триглицериды. Номенклатура, состав, строение, их гидролиз. Биологическая роль.
1.Термодинамические системы: определение, классификация: систем (изолированные, закрытые, открытые) и процессов (изотермические, изобарные, изохорные). Стандартное состояние. Основные понятия термодинамики: внутренняя энергия, работа, теплота.
Термодинамическая система – это ограниченная область пространства, занятая её элементами.
Виды ТС:
1)изолированная (нет обмена ни веществом, ни энергией с окружающей средой) - вселенная
2)закрытая (нет обмена веществом, но есть обмен энергией с окр.средой)
3)открытая (есть обмен и веществом и энергией с окр.средой) – человек, кости, океан.
Типы термодинамических процессов:
1)изотермический – процесс, который протекает при Т= const
2)изобарный – при Р= const
3)изохорный – при V= const
4)адиабатический – при A,Q=const.
Стандартное состояние - состояние вещества, в котором оно находится при температуре 298,15К и давлении 101,325кПа (760 мм ртутного столба).
Внутренняя энергия (U) – это функция состояния, которая может изменяться от совершения работы и выделения теплоты.
Теплота (Q) – энергия, передающаяся за счёт хаотичного движения элементов между системой и окр.средой.
Работа (А или W) – энергия. Передающаяся за счёт упорядоченного движения большого числа элементов между системой и окр.средой.
2.Первое начало термодинамики. Энтальпия. Стандартная энтальпия сгорания, стандартная энтальпия образования вещества. Стандартная энтальпия реакции. Применение первого начала термодинамики к биосистемам.
Теплота, выделившаяся в изобарном процессе, расходуется на увеличение внутренней энергии и совершение работы. !Q=U+A!
Энтальпия реакции (ΔН° р) - это функция состояния, указывающая количество энергии, которую можно преобразовать в теплоту.
Изменение энтальпии равно теплоте, полученной системой в изобарном процессе. !Q p=ΔH!
Стандартная энтальпия сгорания (ΔН°с) – теплота, выделившаяся при сгорании одного моля вещества в избытке О2. Конечные продукты – газы. Теплота сгорания некоторых веществ принимается равной 0.
Стандартная энтальпия образования вещества (ΔН°ƒ) – теплота, выделившаяся или поглотившаяся при образовании 1 моля в-ва из простых в-в, находящихся в стандартном состоянии.
Закон Гесса:
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Первое следствие
Энтальпия реакции = сумм энтальпии образования в-в – сумма энтальпии образования исх.в-в.
ΔН° р= ƩН° прод. – ƩН° исх.в-в.
Второе следствие
ΔН° р=ƩН°с исх.в-в - ƩН°с прод.
Применение первого начала термодинамики к биосистемам:
Энергия, поступающая в бактерии с пищей, разделяется в процессе потребления:
1)выд-ся в среду в виде тепла и энергии, сод-ся в продуктах жизнедеятельности.
2)запасающаяся в клеточном материале.
3.Второе начало термодинамики. Энтропия. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах. Примеры экзергонических и эндергоничсеких процессов, протекающих в организме. Принцип энергетического сопряжения.
Второе начало Т
В изолированных системах самопроизвольно протекают процессы с увеличением энтропии.
Энтропия (ΔS) – функция состояния, энергия, растраченная на приведение системы в беспорядок. !ΔS = Q обр / Т!
Все самопроизвольные процессы обязательно сопровождаются увеличением суммарной энтропии.
Энергия Гиббса (ΔG) – это функция состояния, показывающая изменение энергии в ходе химической реакции.
Когда ΔG>0 эндергическая реакция, ΔG<0 экзергическая реакция, ΔG=0 система в состоянии равновесия.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической - Глюкоза+ Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Экзергоническая р-я Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
Принцип энергетического сопряжения:
1)экз- и эндергические реакции должны протекать одновременно
2)обе реакции должны иметь промежуточный продукт
3)ΔG экзергической реакции по абсолютной величине должна быть больше ΔG эндергической реакции.
4.Зависимость скорости реакции от концентрации. Молекулярность элементарного акта реакции. Порядок реакции. Кинетические уравнения реакции первого и нулевого порядков. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Энергия активации.
Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для
реакции bB + dD = lL + mM
выражение кинетического уравнения
скорости имеет вид![]() .
.
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Если
в реакцию вступает одна молекула, то
такая реакция называется одномолекулярной
реакцией![]() .
Если в реакции участвуют две молекулы,
то такая реакция называется бимолекулярной
H2+I2=2HI.
Встречаются также тримолекулярные
реакции
KClO3+6HCl+6FeCl2=6FeCl3+KCl+3H2O.
.
Если в реакции участвуют две молекулы,
то такая реакция называется бимолекулярной
H2+I2=2HI.
Встречаются также тримолекулярные
реакции
KClO3+6HCl+6FeCl2=6FeCl3+KCl+3H2O.
Порядок реакции – число, равное сумме показателей степеней концентрации реагирующих веществ.
aA+bB+cC<=>mM+nN+pP
1)v1=K[A]a[B]b[C]c
v2=K[M]m[N]n[P]p
2)от конц-ии реакций прямой и обратной
ŋ1=a+b+c, ŋ2=m+n+p.
Реакции
нулевого порядка −
это реакции, в которых скорость процесса
не зависит от концентрации и сохраняется
постоянной во времени.
В
качестве примера можно привести реакцию
гидрирования этилена на платиновом
катализаторе
![]() .
.
Реакции
первого порядка. К
химическим реакциям первого порядка
относятся, как правило, реакции
разложения. Например, реакция разложения
изометана в газовой фазе является
реакцией первого порядка
![]()
Зависимость скорости реакции от температуры
Правило
Вант – Гоффа. При
повышении температуры на 10° скорость
многих реакций увеличивается в 2 – 4
раза![]() где v2 и v1 -
скорости реакции при температурах Т2 и Т1, γ -
коэффициент, значение которого для
эндотермической реакции выше, чем для
экзотермической. Для многих реакций γ лежит
в пределах 2 – 4.
где v2 и v1 -
скорости реакции при температурах Т2 и Т1, γ -
коэффициент, значение которого для
эндотермической реакции выше, чем для
экзотермической. Для многих реакций γ лежит
в пределах 2 – 4.
При
концентрациях реагирующих веществ 1
моль/л скорость реакции численно
равна константе скорости k.
Правило Вант – Гоффа запишется так:![]()
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Уравнение
Аррениуса![]() ,где k –
константа скорости
реакции; А – предэкспоненциальный множитель;
е – основание натурального логарифма; Еа –
постоянная, называемая энергией
активации, определяемая природой
реакции. Значения Еа для
химических реакций лежат в пределах
40 – 400 кДж/ моль.
,где k –
константа скорости
реакции; А – предэкспоненциальный множитель;
е – основание натурального логарифма; Еа –
постоянная, называемая энергией
активации, определяемая природой
реакции. Значения Еа для
химических реакций лежат в пределах
40 – 400 кДж/ моль.
ЭНЕРГИЯ АКТИВАЦИИ в элементарных р-х - миним. энергия реагентов (атомов, молекул и др. частиц), достаточная для того, чтобы они вступили в хим. р-цию.
Температурный коэффициент скорости реакции и его особенности для биохимических процессов:
1)теплота,
2)влияние на интенсивность обменных процессов,
3)диапазон t от +50 до -50,
4)влияние климатических зон и близости моря, рельефа, наличия гор, экспозиции склона.
5.Катализ: гомогенный и гетерогенный. Энергетический профиль каталитической реакции.
Катализ –явление изменения скорости р-ции в присутствии в-в не расходующихся в процессе взаимодействия.
Гомогенный катализ – реагенты и катализатор находятся в одинаковом агрегатном состоянии и между ними нет поверхности раздела фаз.
Гетерогенный катализ – реагенты и катализатор находятся в разном агрегатном состоянии, реакция протекает на поверхности раздела фаз.
Механизм действия катализатора очень сложен. В случае гомогенного катализа катализатор (К) взаимодействует с реагентами (А, В) образует с ними реагентно-способные промежуточные соединения – интермедиаты. В общем виде для р-ции: А+В=Д
В присутствии катализатора: N/W=A+B+K[A…K]+BAK+B(интермедиат)[A…B…K]D+K
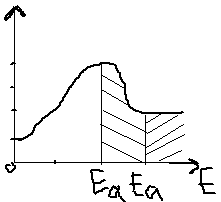
6.Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа хим.Равновесия. Прогнозирование смещения хим.Равновесия.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Необратимые – это реакции, протекающие до конца, т.е. до полного израсходования одного из реагирующих веществ.
Обратимыми –называются реакции, которые могут протекать в рассматриваемых условиях как в прямом, так и обратном направлениях. Когда хотят в самом уравнении реакции подчеркнуть обратимость её в данных условиях, то знак равенства заменяют двумя стрелками противоположного направления
Реакция, протекающая слева направо, называется прямой, а справа налево – обратной.
Константа химического равновесия характеризует сдвиг равновесия обратимой реакции в ту или иную сторону.
Константа химического равновесия зависит от природы реагентов, от температуры и не зависит от давления ( при не очень высоких давлениях) и от концентраций реагентов и продуктов реакции, от наличия или отсутствия примесей.
Выражение константы равновесия для реакции aA + bB <--> cC + dD K = (Сc * [D]d) / ([A]a * [В ]b ) Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, равновесие сместится таким образом, что оказанное воздействие уменьшится.
А)Р ум; Р ув
Б)(+)t ув , ум ; (-)t ув , ум
В) При увеличении концентрации кислорода, как очевидно, должен идти процесс, в котором кислород расходуется, чтобы скомпенсировать увеличение его концентрации. То есть, прямая реакция. Вывод: сместится вправо.
7.Классификация растворов: по степени дисперсности; по степени насыщенности. Коллигативные свойства растворов: закон Рауля, понижение t замерзания р-ра, повышение t кипения р-ра.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По степени дисперсности различают истинные и коллоидные растворы.
При образовании истинных растворов растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Размер частиц в таких растворах равен 10–7 - 10–8 см. Коллоидные растворы относятся к гетерогенным системам, в которых частицы одного вещества (дисперсная фаза) равномерно распределены в другом (дисперсионная среда). Размер частиц в дисперсных системах находится в пределах от 10–7 см до 10–3 и более см.
По степени насыщенности: ненасыщенные, насыщенные и пересыщенные растворы.
Раствор останется ненасыщенным до тех пор, пока в нем может раствориться еще некоторое количество вещества.
Раствор, в котором вещество при данной температуре больше не растворяется, называется насыщенным. Растворимость данного вещества равна его концентрации в насыщенном растворе.
Пересыщенный раствор – это такой раствор, концентрация вещества в котором выше концентрации насыщенного раствора.
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
1
закон Рауля. Давление
насыщенного пара растворителя над
раствором пропорционально молярной
доле растворителя.![]() ,
,
где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
c(р-ля) – мольная доля растворителя;
n(раств. в-ва) – количество растворенного вещества, моль;
n(р-ля) – количество вещества растворителя, моль.
2
закон Рауля. Понижение
температуры замерзания и повышение
температуры кипения растворов по
сравнению с таковыми для чистого
растворителя пропорциональны молярной
концентрации растворенного вещества:
зам![]() ,кип
,кип![]() ,
,
где Dtкип – повышение температуры кипения раствора, °С;
Dtзам – понижение температуры замерзания раствора, °С;
Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;
Кк – криоскопическая константы растворителя, (кг×°С)/моль;
b – моляльная концентрация, моль/кг;
n(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов:tкип.(р-ра) = tкип.(р-ля) + Dtкип., tзам.(р-ра) = tзам.(р-ля) – Dtзам..
