
- •Методические указания к лабораторно – практическому занятию
- •1) Химическое равновесие.
- •2) Обратимые и необратимые по направлению реакции.
- •3) Термодинамические условия равновесия в изолированных и закрытых системах.
- •4) Константа химического равновесия.
- •5) Уравнения изотермы и изобары химической реакции.
- •Методические указания к лабораторно – практическому занятию
- •Гомогенный катализ
- •Ферментативный катализ

Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
«Саратовский государственный медицинский университет имени В.И. Разумовского» Министерства здравоохранения и социального
развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздравсоцразвития России)
Методические указания к лабораторно – практическому занятию
для студентов медицинских специальностей
Химическое равновесие
Дисциплина: общая химия. I курс.
Очная форма обучения. Длительность занятия: 90 минут.
Разработка составлена асс. Куликовой Л.Н.
2011 г
1
Цели
формирование у студентов представлений о факторах, влияющих на смещение равновесия биохимических процессов.
Исходные знания студентов:
Закон действующих масс. Принцип Ле-Шателье.
Студент должен знать: понятие «химическое равновесие». Термодинамические условия химического равновесия в изолированных и закрытых системах. Константа химического равновесия. Уравнения изотермы и изобары химических реакций.
Студент должен уметь: прогнозировать результаты физико-химических процессов, протекающих в живых системах, опираясь на теоретически положения, в зависимости от изменения температуры и давления (расчеты по уравнениям изотермы и изобары химической реакции).
План подготовки:
1.Ознакомиться с вопросами для подготовки к занятию.
Вопросы для подготовки к занятию
1)Химическое равновесие.
2)Обратимые и необратимые по направлению реакции.
3)Термодинамические условия равновесия в изолированных и закрытых системах.
4)Константа химического равновесия.
5)Уравнения изотермы и изобары химической реакции.
2.Осмыслить краткий теоретический материал (приложение 1) и текст лекции «Основные понятия термодинамики. Первое и второе начала термодинамики».
3.Если определённые участки лекции трудны для понимания, то необходимо обратиться к следующим учебникам:
№п/п |
Авторы |
Название |
Страницы |
|
|
Ершов Ю.А., |
Общая химия. Биофизическая |
|
|
1 |
Попков А.С., |
химия. Химия биогенных |
32-41 |
|
Берлянд А.С., |
элементов.- М.: Высш. шк.-2000.- |
|||
|
|
|||
|
Книжник А.З. |
560 с. |
|
|
2 |
Глинка Н.Л. |
Общая химия. - Л.: Химия.-1978.- |
184-201 |
|
720 с. |
||||
|
|
|
||
|
Равич-Щербо |
Физическая и коллоидная химия.- |
|
|
3 |
М.И., Новиков |
17-19 |
||
М.: Высш. шк.-1975.-255 с. |
||||
|
В.В. |
|
||
|
|
|
||
|
|
|
2 |
|
|
Введение в бионеорганическую и |
|
4 |
Ленский А.С. |
биофизическую химию.- М.: Высш. |
80-92 |
|
|
шк.-1989.-256 с. |
|
4.Ответить на вопросы для самоконтроля (приложение 2).
5.Выполнить тренировочный тест и проверить правильность выполнения по ключу (приложение 3).
6.Решить ситуационную задачу (приложение 4).
Приложение 1: Краткий теоретический материал
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны между собой.
В равновесии изменения изобарно-изотермического потенциала (∆G) и изохорно-изотермического потенциала (∆F) равны нулю.
Закон действующих масс:
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
aA + bB ↔ сС + dD
K |
p |
= |
|
|
(РDd ·PCc) /( РAa ·PBb)
а, b, c, d - стехиометрические коэффициенты
Константа равновесия может быть выражена не только через парциальные давления газообразных участников реакции, но и через молярные концентрации и мольные доли исходных веществ и продуктов реакции.
КР= КС (RT)∆n = Кχ (Pобщ) ∆n
КС – константа равновесия, выраженная через концентрации участников реакции
R- газовая постоянная, R=8,314 Дж/(моль К)
∆n-разность количеств вещества конечных и исходных газообразных участников реакции
Кχ– константа равновесия, выраженная через мольные доли участников реакции
Робщ – общее давление.
Направление химической реакции определяют по величине изобарноизотермического потенциала:
ΔG<0 - протекает прямая реакция; самопроизвольный процесс; ΔG=0, система находится в состоянии равновесия;
ΔG>0, протекает обратная реакция; несамопроизвольный процесс.
Рассчитывают ΔG по уравнению изотермы химической реакции:
3
ΔGх.р. = - RT ln Kp + RT ln (РDd ·PCc / РAa ·PBb) R- газовая постоянная, R=8,314 Дж/(моль К).
Kp –константа равновесия
РD , РС - неравновесные давления газообразных продуктов реакции РА , РB - неравновесные давления газообразных исходных веществ.
- RT ln Kp= ΔG0298, х.р.
Способы расчёта изобарно-изотермического потенциала:
1) G2980 |
,х. р. = H 2980 |
− 298 S2980 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
H |
0 |
= ( |
|
H |
0 |
|
|
|
) |
|
|
− ( |
|
H |
0 |
|
) |
|
|
, |
|||||||||||||||
|
298 |
i |
|
f ,298 |
кон |
j |
f ,298 |
исх |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
S |
0 |
= ( |
|
|
S |
0 |
|
|
) |
|
|
|
− ( |
|
S |
0 |
|
|
) |
|
|
|
|
|
|
|
|||||||||
|
298 |
i |
|
298 |
кон |
j |
298 |
исх |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2) |
G |
0 |
|
= ( |
|
G |
0 |
|
|
)кон − ( |
|
G |
0 |
|
|
) |
|
|||||||||||||||||||
298,х. р |
i |
f ,298 |
j |
f ,298 |
исх |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
G |
0 |
f , |
|
|
298, |
- стандартное изменение энергии Гиббса при образовании 1 моля
вещества из простых веществ (справочные данные).
Принцип ЛеШателье:
если на систему, находящуюся в состоянии равновесия подействовать извне, то система смещает равновесие в сторону противодействия внешнему воздействию.
Повышение температуры смещает равновесие в сторону протекания эндотермического процесса. Повышение давления - в сторону образования меньшего числа моль газообразных веществ.
Зависимость константы химического равновесия от температуры при постоянном давлении описывает уравнение изобары Вант-Гоффа: дифференциальная форма уравнения изобары
d ln K p |
|
H 0 |
|
|||
|
|
|
= |
|
|
|
|
|
|
|
|||
|
dT |
|
RT |
2 |
, |
|
|
p |
|
|
|||
где R- газовая постоянная, R=8,314 Дж/(моль К);
Kp – константа равновесия, выраженная через давления; Т – температура; ∆Н – тепловой эффект реакции.
интегральная форма уравнения изобары
4

|
K |
2 |
|
H T |
−T |
|
||
ln |
|
= |
|
|
2 |
1 |
|
|
|
|
|
|
|
||||
|
K |
1 |
|
R |
|
T |
T |
|
|
|
|
|
|
2 |
1 |
|
|
К1, К2 –константы химического равновесия реакции при температурах Т1 и Т2.
Зависимость константы химического равновесия от давления описывает
уравнение Планка – Ван – Лаара:
d ln K x = − n dP P
Кх – константа химического равновесия, выраженная через мольные доли; Р – давление;
∆n – изменение числа моль газообразных участников реакции.
Приложение 2: Вопросы для самоконтроля
1)Что называют химическим равновесием?
2)Какие реакции называют обратимыми по направлению реакции?
3)Какие реакции называют необратимыми по направлению реакции?
4)Назовите термодинамические условия равновесия в изолированных и закрытых системах.
5)Какими способами рассчитывают ∆G? Приведите расчётные формулы.
6)Через какие характеристики системы можно выразить константу равновесия?
7)Запишите уравнение изотермы и изобары химической реакции.
Приложение 3: Тренировочный тест
1.В системе 2SО2 + O2 —> 2SO3 исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01моль/л. Константа равновесия равна а) 180 б)260 в) 525 г) 800
2. При 508°С константа скорости реакции Н2(г) + J2(г) —>2HJ(г) равна 0,16 л/(моль·мин). Исходные концентрации Н2 и J2 соответственно равны 0,04 и 0,05 моль/ л. Начальная скорость реакции составляет_________ моль/( л·мин).
а) 3,2·10-4 б) 1,92·10-4 в) 9,6 ·10-5 г) 2,8 ·10-5
5
3. В системе 2SО2(г) + O2(г) —> 2SO3(г) исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01, а равновесная [SО3] _____моль/ л
а) 0,005 б) 0,01 в) 0,02 г) 0,05
4.Если в системе 2Са(к) + О2(г) —> 2СаО(к) увеличить давление в 2 раза, то скорость прямой реакции а) возрастет в 4 раза б) возрастет в 2 раза в) понизится в 2 раза г) не изменится
5.Исходная концентрация СО и Сl2 в системе СО + Сl2 —>СОСl2 были равны 0,3 и 0,2 моль/л. Если концентрацию СО повысить до 0,6, а Сl2 до 1,2
моль/л, то скорость реакции между ними увеличится в а) 2 раза б) 6 раз в)12 раз г) 24 раза
Эталоны ответов к тесту: 1а, 2а, 3а, 4б, 5в
Приложение 4: Ситуационные задачи.
1)Константа равновесия системы СО2(г) + Н2(г) —> CO(г) + Н2О(г) равна 1. В начальный момент [СО2] и [Н2] были соответственно равны 0,2 и 0,8 моль/ дм3. Концентрация [СО] равн. Составляет ______(моль/ дм3)
2)Запишите выражения КР для реакций:
1.CO + H2 = С граф +H2O газ
2.2CI2 + 2H2O газ = 4HCI(г) + О2
Как связаны КР и КС для этих реакций?
3) Железо и водяной пар реагируют по уравнению:
Fe тв + H2O газ = FeО тв + H2 газ. При температуре 1298К и Робщ = 1атм равновесие наблюдается при РH2 = 0, 562 атм. и Р H2O = 0,438 атм. При температуре 1173К равновесие наблюдается при Р(H2)= 0,592 атм., Р (H2O) = 0,408 атм. Рассчитайте средний тепловой эффект реакции в этом интервале температур.
6
4) При 1000К для реакции SO2 + NO2 = SO3 +NO; Кр = 7,6. В каком направлении будет протекать реакция при РSO2 = 1 атм.; PNO2 = 6 атм.; PSO3
= 2 атм.; PNO= 3 атм.
5) Напишите уравнение, описывающее влияние давления на химическое равновесие. Приведите примеры реакций, на равновесие которых влияет
|
давление и не влияет. |
|
|
|
|
|
||
6) |
Как |
влияет |
общее |
давление |
на |
равновесие: |
||
|
FeCO3 кр = FeO кр + CO2? |
|
|
|
|
|||
7) Для реакции N2+3H2 = 2NH3 |
при 6230К КР = 7,23 · 10 -14 (Н/м2)-2. В каком |
|||||||
|
направлении |
будет |
протекать |
процесс |
при: |
|||
|
РN2 = PH2 = PNH3 = 1,0132 · 105 Н/м2. |
|
|
|
||||
8) |
Как |
нужно |
изменить |
|
условия |
проведения |
реакции |
(Т и Р) |
|
CO + H2O(газ) = CO2 +H2, чтобы сдвинуть равновесие в сторону продуктов, |
|||||||
|
если |
Н0800К = -36994 Дж/моль. |
|
|
|
|||
9). Для реакции: 2CO + 2H2 = CH4 + CO2 |
при 1000К КР = 2,57 · 10-8 (Н/м)-2. |
|||||||
|
Определить, в каком направлении будет протекать реакция, если: |
|||||||
РСО = 1,0132 · 104; РН2 = 2, 0264 · 104;
РСН4 = 2, 0264 · 104; РСО2 = 6, 0792 · 104 Н/м2
10). Для реакции СТВ + 2Н2 Г = СН4 г, при 973К КР = 0, 1924 · 10-5 Н/м2, а при
|
1033К |
КР = 0,1159 · 10-5. Вычислить средний тепловой эффект реакции в |
|||
|
этом интервале температур. |
|
|
|
|
11) |
Что требуется сделать для для смещения равновесия гомогенной |
||||
|
химической реакции 2НI → 2H2 + O2, |
H < 0, в сторону продуктов? |
|||
12) |
Как |
увеличить |
выход |
продуктов |
реакции |
2Pb(NO3)2 (тв) 2 PbO(тв)+4 NO2(г)+О2 (г), |
H > 0. |
|
|||
13) |
Запишите уравнение константы равновесия гетерогенной химической |
||||
реакции 2H2S(г) + SO2 (г) 2S(к) + 2H2O(г) К = [H2O]2 / [H2S]2 · [SO2] |
|
||||
7

Лабораторная работа
Влияние изменения концентраций на химическое равновесие.
Воздействие концентраций на равновесие изучим на примере реакции хлорида железа (+3) с роданидом калия. м.
Обычно полное уравнение реакции представляют так:
FeCl3 + 3KSCN Fe(SCN)3 + 3KCl.
Этому молекулярному уравнению можно сопоставить разные ионные. Если считать, что хлорид железа полностью распадается на ионы, а роданид
железа совсем не распадается, получается следующее сокращённое ионное уравнение:
Fe3+ + 3SCN– 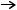 Fe(SCN)3.
Fe(SCN)3.
Частичной диссоциации обеих солей железа отвечают другие ионные уравнения, например, такое:
FeCl2+ + 2SCN– Fe(SCN)2+ + Cl–.
Запишите стандартное выражение для константы данного равновесия.
В пробирку налейте 10 мл раствора KSCN и прибавьте 1–2 капли разбавленного раствора FeCl3. Должен получиться слабоокрашенный раствор. Его разделите на 4 равные порции.
К первой порции прибавьте концентрированный раствор FeCl3. Во вторую порцию всыпьте ложечку сухого KSCN. К третьей порции добавьте ложечку сухого KCl или влейте 1–2 мл концентрированной HСl. Четвёртая пробирка предназначена для сравнения (исходное состояние).
Единственным ярко окрашенным веществом в системе является соединение ионов железа и роданида.
Проанализируйте изменения цвета в порциях 1-3 с точки зрения принципа Ле-Шателье. Какой из вариантов ионного уравнения противоречит опыту?
Сделайте выводы о проделанной работе.
8
