
Методичка по химии
.pdfЛАБОРАТОРНЫЕ РАБОТЫ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ ПО ОБЩЕЙ ХИМИИ.
Часть І
Москва 2009

Составители: канд. хим. наук Т. В. Мельникова канд. хим. наук Н. П. Храмеева канд. хим. наук И. Я. Логинова
Лабораторные работы по общей химии. Ч. I. / Сост. Т. В. Мельникова, Н. П. Храмеева, И. Я. Логинова. – М.: Изд-во Рос.
экон. акад., 2006. – 56 с.
Лабораторные работы составлены в соответствии с программой дисциплины «Общая химия».
Для студентов специальности 260501.65 «Технология продуктов общественного питания», 080401.65 «Товароведение и экспертиза товаров (по областям применения)», 080502.65 «Экономика и управление на предприятии (в торговле)»
Российская экономическая академия, 2009
2
Введение.
Представленные лабораторные работы по общей химии и неорганической химии отражают современные состояние изучаемой науки и включают те разделы химии, которые важны для дальнейшего изучения обще химических и специальных дисциплин.
Общие правила работы в лаборатории
Лабораторные работы по химии проводят в специально оборудованной химической лаборатории.
За каждым студентом на время работы закрепляют место на рабочем столе.
Впроцессе работы необходимо содержать рабочее место в порядке
ичистоте.
Запрещается класть на стол портфели, книги, свертки т.п., а по окончанию работы необходимо убрать рабочее место и тщательно вымыть химическую посуду.
В химической лаборатории нужно особенно строго соблюдать правила техники безопасности, с которыми каждый должен хорошо ознакомиться в первый же день работы. Нарушение их может привести к несчастным случаям.
При нагревании нельзя держать пробирки отверстием к себе или работающему рядом, нельзя наклоняться над отверстием сосуда, в котором протекает реакция.
Если на кожу попала концентрированная кислота или щелочь, то пораженное место следует тотчас же промыть большим количеством воды, после чего обработать
вслучае кислоты – 5% раствором питьевой соды или разбавленным раствором аммиака;
вслучае щелочи – разбавленным раствором уксусной кислоты.
При получении ожогов от прикосновения к горячему предмету надо
обожженное место покрыть марлей, пропитанной 2%-ным раствором перманганат калия. Необходимые медикаменты всегда имеются в лабораторной аптечке.
Испытывать газы на запах нужно осторожно:
Пробирку следует держать в левой руке так, чтобы отверстие находилось ниже уровня носа, и правой рукой направлять к себе слабый поток воздуха.
Каждый студент должен знать, где в лаборатории находится аптечка, простейшие средства огнетушения (вода, песок, кошма (одеяло), огнетушитель), а также запасный выход из лаборатории.
3
Порядок выполнения лабораторных работ.
1.Перед каждой лабораторной работой следует изучить относящейся к ней теоретический материал.
2.Начинать опыт, только внимательно прочитав полное описание работы и уяснив порядок ее выполнения.
3.Лабораторные работы выполняются индивидуально, за исключением тех, которые по указанию преподавателя проводятся группами.
4.не следует, брать реактивы в большем количестве, чем требуется для опыта.
5.Неизрасходованные или взятые в избытке реактивы нельзя возвращать обратно в склянки, их надо сдавать лаборанту.
6.Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
7.Все работы с концентрированными кислотами и щелочами проводить только под тягой и не переносить их на свое рабочее место.
8.Не путать пробки от склянок, а также шпатели, лопатки , пипетки для взятия реактивов.
9.Бумагу, отходы твердых веществ бросать в урну или в банки.
10.Соблюдать в лаборатории тишину.
11.Обязательно вести запись проведенных лабораторных работ. Пока выполненный опыт не записан, не переходить к следующему.
Ведение лабораторного журнала
В журнал заносят все наблюдения, схемы установок, уравнения реакций, вычисления, выводы, а также ответы на вопросы и решение задач.
Не следует вести записи на отдельных листках, т.к. они могут потеряться; кроме того это приучает к неряшливости.
Конспект лабораторной работы подготовить дома по следующей схеме:
1.Дата.
2.Название лабораторной работы и ее номер по порядку.
3.Название опыта и его номер.
4.Схема прибора, уравнения реакций, графики, таблицы в молекулярной и ионной форме.
5.Наблюдение.
6.Выводы.
7.
4

Тема 1. Скорость химических реакций и химическое равновесие
Химическая кинетика изучает скорость и механизм химических процессов.
Скорость определяется изменением концентрации веществ реакционной системы в единицу времени при постоянном объеме системы. Она зависит от природы реагирующих веществ, концентрации, температуры, присутствия катализатора и других факторов. Для реакций с участием твердых веществ скорость реакции зависит также и от степени измельчения, а для газов – от давления.
Скорость реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степени их стехиометрических коэффициентов – Закон действующих масс (з.д.м.), выражаемый кинетическим уравнением для реакций
mA + nB = pC + qD V=k. CAm . CBn
где V – скорость химической реакции; k – константа скорости, которая зависит от тех же факторов, что и скорость, но не зависит от молярных концентраций СА и СВ реагирующих веществ А и В; m и n – стехиометрические коэффициенты.
З.д.м. применим только к гомогенным (однородным) системам. Течение гетерогенных процессов во многом зависит от площади и состояния поверхности, так как соударения, например, газообразного и твердого вещества могут происходить только на поверхности раздела фаз. Поэтому концентрация твердого вещества в кинетическом уравнении не учитывается. Для реакции C(ТВ) + O2(г) = CO2
V kCO2 .
Зависимость скорости химической реакции от температуры опреде-
ляется правилом Вант-Гоффа: при повышении температуры на каждые 100 скорость химической реакции увеличивается примерно в 2–4 раза
Т 2 -Т1
VT2 VT1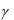 10 ,
10 ,
где VT1 – скорость реакции при температуре T1; VT2 – скорость реакции при температуре T2; γ– температурный коэффициент скорости ре-
5
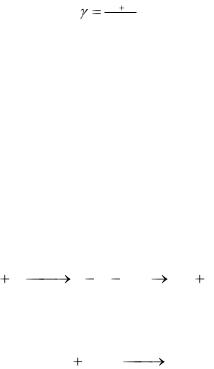
акции, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10о
kТ 10 ;
kT
где kT – константа скорости при температуре Т; kT+10 – константа скорости при температуре Т+10.
Катализом называют увеличение скорости реакции, происходящее под действием специальных веществ – катализаторов. Катализаторы не входят в конечные продукты реакции. Катализ по фазовому состоянию делят на гомогенный и гетерогенный.
В гомогенном катализе реагирующие вещества и катализатор находятся в одной и той же фазе. Механизм гомогенного катализа можно объяснить, исходя из теории промежуточных соединений, т. е. вначале катализатор вступает в реакцию с реагирующим веществом и образует промежуточное соединение. Эта реакция идет, как правило, быстро, затем промежуточное соединение разлагается, выделяя катализатор и продукт реакции. Общая скорость каталитической реакции определяется скоростью распада промежуточного соединения
A B |
kat |
A B Kat AB Kat . |
|
В гетерогенном катализе реагирующие вещества и катализатор находятся в различных фазах.
С2H4(r ) H2( Г ) |
Ni |
C2H6(r ) |
|
Катализатор образует отдельную фазу, обычно твердую, и реакция идет на поверхности раздела этих фаз. В теории гетерогенного катализа важную роль играет адсорбция, т. е. «сгущение» (концентрирование) газообразных или растворенных веществ на поверхности другого вещества (твердого или жидкого).
Химическое равновесие
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми. Реакции, идущие одновременно в двух противоположных направлениях
(прямом и обратном), называются обратимыми. Химическим равновеси-
ем называется такое состояние системы, при котором скорости прямой и обратной реакции равны (Vпр= Vобр). Каждое химическое равновесие ус-
6

танавливается при определенном значении трех параметров, которые его характеризуют:
1)концентрации реагирующих веществ С;
2)температуры Т;
3)давления Р для газов. Изменение одного из этих параметров определяет характер внешнего воздействия на систему и приводит к нарушению равновесия. Установившееся новое равновесие оказывается смещенным по отношению к исходному. Направление смещения равновесия определяется принципом Ле-Шателье, согласно которому, если изменить одно из условий (концентрацию веществ, температуру или давление), при которых система находится в состоянии равновесия, то равновесие смещается в сторону того процесса, который уменьшает произведенное воздействие (принцип противодействия).
1. Увеличение концентрации исходных веществ смещает равновесие
всторону продуктов реакции и наоборот, например,
у величениеССO илиС O2 
2СО + О2 2СО2
увеличениеССO2
2. Повышение температуры смещает равновесие в сторону эндотермической реакции (идущей с поглощением тепла), а понижение – в сторону экзотермической реакции (идущей с выделением тепла), например,
понижениеТ 
2Н2 (г) + О2 (г) 2 Н2О(ж) – 285,8 кДж
повышение Т
3. Изменение давления смещает равновесие, если в реакции участвуют газообразные вещества и число молекул исходных газообразных веществ и газообразных продуктов реакции неодинаково. При увеличении давления равновесие смещается в сторону уменьшения давления, т. е. образования меньшего числа молекул газообразных веществ и наоборот, например,
повышение р
N2(г) + 3Н2(г) 2NH3(г)
понижение р
7
Лабораторная работа 1. Влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной системе
В этом опыте изучается реакция разложения тиосерной кислоты H2S2O3 при различных ее концентрациях. Известно, что соли тиосерной кислоты устойчивы как в твердом состоянии, так и в растворе, а сама тиосерная кислота разлагается с образованием сернистой кислоты H2SO3 и серы.
По степени помутнения суспензии выделившейся серы можно судить о количестве разложившейся тиосерной кислоты и, следовательно, определить зависимость скорости реакции от концентрации реагирующих веществ.
Реакция тиосульфата натрия с серной кислотой происходит по уравнению
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O.
Для проведения опыта следует приготовить четыре раствора тиосульфата натрия различной концентрации. Для этого в четыре пробирки, на задних стенках которых нанесены вертикальные темные линии, из бюреток налить:
–в первую пробирку – 2 мл 0,5 н раствора Na2S2O3 и 4 мл воды;
–во вторую пробирку – 3 мл 0,5 н раствора Na2S2O3 и 3 мл воды;
–в третью пробирку – 4 мл 0,5 н раствора Na2S2O3 и 2 мл воды;
–в четвертую пробирку – 6 мл 0,5 н раствора Na2S2O3 .
Таким образом, в одинаковых объемах полученных растворов (6 мл) будет содержаться различное число молей Na2S2O3. Если условно обозначить концентрацию Na2S2O3 в первой пробирке – С моль, то во второй пробирке концентрация будет 1,5 С, в третьей – 2 С, в четвертой – 3 С.
В другие четыре пробирки налить из бюретки по 6 мл 0,5 н H2SO4. Влить в первую пробирку с раствором Na2S2O3 6 мл 0,5 н H2SO4 и быстро перемешать содержимое пробирки.
По секундомеру или секундной стрелке часов измерить время от момента добавления серной кислоты (начало опыта) до начала исчезновения темной полоски на пробирке в результате помутнения раствора от выпавшей свободной серы (конец опыта).
Аналогичные опыты провести с остальными растворами. Данные опыта внести в табл.1.
8

|
|
|
|
|
|
|
Таблица 1 |
|
, |
|
|
|
теченияВремяреакции,с |
Скоростьреакции в ед.усл.,1/ |
Соотношениескорореакциистей |
пробирки№ |
3 |
водыОбъем, мл |
Концентрация Na |
||||
0,5Объемн Na |
мл |
||||||
|
O |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
S |
|
|
С |
|
|
|
|
2 |
|
|
|
|
||
|
|
|
|
3, |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
4 |
1,0 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
3 |
3 |
1,5 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
4 |
2 |
2,0 |
|
|
|
|
|
|
|
|
|
|
|
4 |
|
6 |
– |
3,0 |
|
|
|
|
|
|
|
|
|
|
|
На основании данных табл. 1 начертить график зависимости скорости реакции от концентрации (на оси абсцисс – соотношения концентрации Na2S2O3, на оси ординат – соотношения скоростей, приняв минимальную скорость за единицу, а все другие – выразив в кратных ей значениях). При построении графика удобнее принять масштаб для минимальной скорости и минимальной концентрации равный 2 см. Как зависит скорость реакции от концентрации реагирующих веществ?
Опыт 2. Влияние температуры на скорость химической реакции
вгомогенной системе
Вчетыре пронумерованные пробирки налить из бюретки по 5 мл
0,5н раствора Na2S2O3, а в четыре другие – по 5 мл 0,5н раствора H2SO4 Все пробирки поместить в химический стакан (на 200–250 мл) с водой и через 5 минут, измерив и записав температуру воды в стакане, в первую
пробирку с тиосульфатом влить 5 мл 0,5н раствора H2SO4. С помощью секундомера измерить время от момента добавления кислоты до начала исчезновения темной полоски на пробирке.
Стакан с водой и остальными пробирками поставить на электрическую плитку. Медленно нагреть воду в стакане на 10о выше первоначальной температуры и провести аналогичный опыт с пробиркой 2. Далее последовательно нагревая воду в стакане каждый раз на 10о выше предыдущей температуры, провести опыты с пробирками 3 и 4.
Полученные данные занести в табл. 2.
9

|
|
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
Время |
Скорость |
|
|
№ |
про- |
Температура |
течения |
реакции |
в |
Соотношение |
||
реакции |
усл. ед., 1/ |
|
||||||
бирки |
|
опыта, |
о |
С |
|
скоростей |
||
|
|
, с |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Строят график зависимости скорости реакции от температуры (V=f(t)). На оси абсцисс – температура, на оси ординат – соответствующие им соотношения скоростей.
Как зависит скорость реакции от температуры?
Опыт 3. Влияние катализатора на скорость химической реакции
1.Каталитическое разложение пероксида водорода (гетерогенный катализ)
В пробирку налить 2 мл 3%-ного раствора пероксида водорода. Отметить, что в обычных условиях заметного разложения пероксида водорода не наблюдается.
Затем к раствору добавить микрошпателем немного оксида марганца (IV) и наблюдать энергичное разложение пероксида водорода с выделением кислорода (тлеющая лучина, поднесенная к отверстию пробирки, загорается).
Написать уравнение реакции разложения пероксида водорода. Каково значение оксида марганца (IV) в этой реакции?
2.Гомогенный катализ
В две пробирки налить по 3 мл концентрированного раствора роданида аммония NH4SCN и по 3 капли насыщенного раствора FeCl3. В одну их них добавить 2 капли 1н раствора CuSО4 (катализатор), после чего, добавив в обе пробирки по 3 мл 0,5н раствора Na2S2O3, сравнить скорость обесцвечивания растворов в обеих пробирках.
Реакция протекает по уравнениям
3NH4SCN + FeCl3 Fe(SCN)3 + 3NH4Cl
2Fe(SCN)3 + 2Na2S2O3Na2S4O6 + 2NaSCN + 2Fe(SCN)2
красный р-р бесцветный р-р
Опыт 4. Влияние величины поверхности реагирующего вещества на скорость реакции в гетерогенной системе
Налить в две пробирки по 2–3 мл 2н раствора соляной кислоты. Взять два одинаковых кусочка мела (CaCO3) и один из них растереть в порошок. В одну пробирку опустить кусочек мела, в другую – порошок.
10
