
Методичка по химии
.pdf
Обратить внимание на скорость выделения пузырьков газа в обеих пробирках.
Написать соответствующее уравнение реакции. Объяснить, почему скорость растворения мела в этих случаях различна.
Опыт 5. Влияние изменения концентраций реагирующих веществ на равновесие химической реакции
Провести обратимую реакцию
FeCl3 + 3NН4SCN Fe(SCN)3 + 3NH4Cl.
В химический стакан налить 20 мл воды и добавить по 1–2 капли насыщенных растворов хлорного железа (III) и роданида аммония. Полученный раствор разлить поровну в четыре пробирки. Добавить следующие реактивы:
впервую пробирку – 2 капли насыщенного раствора FeCl3; во вторую – 2 капли насыщенного раствора NH4SCN;
втретью – несколько кристалликов NH4Cl.
Сравнить интенсивность окраски полученных растворов с интенсивностью окраски раствора четвертой пробирки.
Записать свои наблюдения.
Какое вещество придает раствору красную окраску?
В каком направлении сместится равновесие данной реакции при до-
бавлении: а) FeCl3; б) NH4SCN; в) NH4Cl?
Задания для самостоятельной работы
1. Как изменяются скорости прямых и обратных реакций?
а) 2NO + O2 2NO2;
б) H2 + Cl2 2HCl;
если при постоянной температуре:
–уменьшить концентрацию каждого вещества в 2 раза;
–увеличить давление в 3 раза?
Ответ: а) 8;4 б) 9;9..
2. В каком направлении будет смещаться равновесие следующих обратимых реакций если повысить давление, если повысить температуру?
а) С + H2O СО + Н2, + Н;
б) N2 + 3H2 2NH3, |
– Н; |
3. Температурный |
коэффициент скорости реакции равен 2. Во |
сколько раз увеличивается скорость реакции при повышении температуры от 10о до 50о?
Ответ: в 16 раз.
11
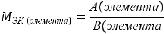
4. Написать формулы констант равновесия для систем:
N2 |
+ 3H2 2NH3 |
CO2 + C СО |
N2 |
+ O2 2NO |
2H2O 2Н2 + O2 |
Тема II Молярная масса эквивалентов элемента и сложных веществ. Закон эквивалентов.
Эквивалентом называют реальную или условную частицу вещества, которая взаимодействует с одним атомом или ионом водорода в обменных реакциях или соответствует одному электрону в окислительновосстановительных реакциях.
Молярная масса эквивалента – это, масса одного моль эквивалента вещества, выраженная в граммах.
Молярную массу эквивалента элемента (МЭК(элемента)) вычисляют по формуле:
где А – атомная масса элемента, В – валентность (или степень окисления) элемента.
Молярная масса эквивалента водорода равна 1 г/моль, кислорода – 8г/моль.
Молярная масса эквивалента элемента с переменной степенью окисления имеет несколько значений.
Например:
Молярная масса эквивалента меди в CuO
МЭК(Cu) = |
64 |
= 32 г/моль, |
|||
2 |
|||||
|
|
|
|
||
и в Cu2O |
МЭК(Cu) = |
64 |
= 64 г/моль |
||
1
Молярная масса эквивалентов сложных веществ рассчитывается по следующим формулам:
МЭК(оксида) = МЭК(элемента) + МЭК(кислорода)
Например:
Молярная масса оксида железа (III) Fe2O3:
12

МЭК(Fe2O3) = MЭК(Fe) + МЭК(кислорода) = |
56 |
+8 = 26,7 г/моль |
|
3 |
|||
|
|
где, М(кислоты) – молярная масса кислоты,
nH+ - число замещенных ионов водорода, участвующих в данной реакции. (основность кислоты).
Например, в реакциях:
H3PO4 + NaOH = NaH2PO4 + H2O
МЭК(H3PO4) = |
|
М(Н3РО4) |
|
= 98 г/моль |
1 |
|
|||
|
|
|
||
H3PO4 + 2NaOH = NaHPO4 + 2H2O |
||||
МЭК(Н3РО4) = |
|
М(Н3РО4) |
|
= 49 г/моль |
2 |
|
|||
|
|
|
||
H3PO4 + 3NaOH = Na3PO4 + 3H2O |
||||
МЭК(Н3РО4) = |
|
М(Н3РО4) |
|
= 32,7 г/моль |
3 |
|
|||
|
|
|
||
где М(основания) – молярная масса основания,
nОH –- – число гидроксильных групп основания, замещенных в данной реакции.
Например, в реакциях: |
|
||
Ba(OH)2 |
+HCl = BaOHCl + H2O |
||
МЭК(Ва(ОН)2) = |
М(Ва(ОН)2) |
= 171 г/моль |
|
1 |
|||
|
|
||
Ba(OH)2 |
+2HCl = BaCl2 + 2H2O |
||
13
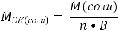
МЭК(Ва(ОН)2) = |
М(Ва(ОН)2) |
= 85,5 г/моль |
|
2 |
|||
|
|
Молярную массу эквивалента соли (МЭК(соли)) рассчитывают по формуле:
где n- число ионов металла, В – заряд иона металла.
Например:
МЭК(Al2(SO4)3) = |
M(Al2(SO4)3) |
= |
M(Al2(SO4)3) |
nAl3+•BAl |
2•3 |
Молярную массу эквивалента кислой и основной солей определяют исходя из уравнений реакций:
а) NaHSO4 + NaOH = Na2SO4 + H2O, |
|
|||
|
М(NaHSO4) |
|
+ |
|
MЭК(NaHSO4) = |
|
|
(замещается один ион Н ) |
|
|
1 |
|||
|
|
|
|
|
б) Fe(OH)2CH3COO + 2CH3COOH = Fe(CH3COO)3 + 2H2O, |
||||
MЭК(Fe(OH)2CH3COO) = |
М(Fe(OH)2CH3COO) |
(замещаются два иона ОН-) |
||
|
2 |
|||
|
|
|
|
|
в)FeOH(CH3COO)2 + 3HCl = FeCl3 + 2CH3COOH + H2O, |
||||
MЭК(FeOH(CH3COO)2) = |
М(FeOH(CH3COO)2) |
(ОН- и два иона СН3СОО- |
||
|
3 |
|||
|
|
|
|
|
замещены на три хлорид иона).
В общем случае молярную массу эквивалента любого вещества определяют по формуле:
МЭК (вещества) = МЭК (вещества) • |
1 |
|
Z |
||
|
14
где МЭК(вещества) – молярная масса вещества,
 - фактор эквивалентности, где Z – число замещенных валентностей (ионов Н+, ОН- или электронов).
- фактор эквивалентности, где Z – число замещенных валентностей (ионов Н+, ОН- или электронов).
Закон эквивалентов: массы реагирующих веществ пропорциональны их молярным массам эквивалентов
m |
|
М ЭК ( А) |
|
|
( А) |
|
|
|
, |
m( В ) |
|
М |
ЭК ( В ) |
|
|
|
|||
где m(А) и m(В) – массы реагирующих веществ А и В; МЭК (А) и МЭК (В) – молярные массы эквивалентов веществ А и В. Другими словами: вещест-
ва реагируют между собой в эквивалентных количествах, т. е. число эквивалентов исходных веществ А и В и продуктов реак-
ции С равны между собой поскольку
m( A) |
|
m( B) |
|
m(C ) |
|
n ЭК (А, В, С) (число моль эквивалентов |
|
|
|
|
|
|
|
М ЭК ( А) |
|
М ЭК ( В) |
|
М ЭК (С ) |
||
nA |
|
nВ |
|
|
nC соответствующих веществ). |
|
nA = nВ = nC
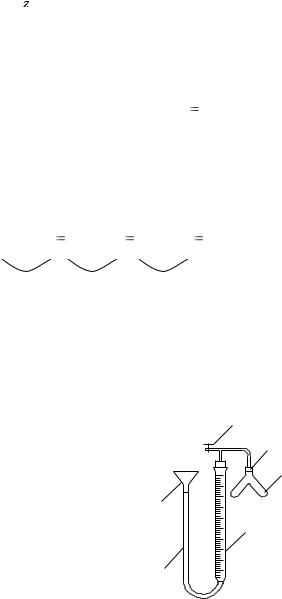
Лабораторная работа 2: определение молярной массы эквивалента металла.
В данной работе эквивалент цинка определяется по объему водорода, вытесненного им из раствора соляной кислоты в соответствии с реак-
цией Zn + 2HCl = ZnCl2 + H2.
Для проведения опыта используют прибор, изображенный на рис. 1.
2
6
1
4
3
5
15
Рис. 1. 1 – двухколенная пробирка; 2 – зажим или стеклянный кран; 3 – бюретка на 50 мл; 4 – уравнительный сосуд; 5 – соединительный шланг; 6 – резиновые пробки.
В одно из колен пробирки поместить кусочек цинка, взвешенный на аналитических весах с точностью до 0,0002 г. В другое колено осторожно (чтобы не смочить стенки пробирки) налить 5 мл раствора соляной ки-
слоты (1:1).
Пробирку (1) плотно надеть на пробку (6), зажим (2) закрыть, при этом прибор изолируется от внешней среды, а бюретка соединяется с пробиркой.
Затем следует проверить прибор на герметичность. Для этого уравнительный сосуд (4) опустить так, чтобы уровень воды в нем был ниже уровня воды в бюретке. В таком положении его закрепить. При опускании уравнительного сосуда уровень воды в бюретке несколько снизится и, если прибор герметичен, дальнейшее понижение уровня воды не произойдет. Если обнаружится, что прибор не герметичен, то необходимо найти причину и устранить ее (проверить места соединения).
После испытания на герметичность следует привести воду в бюретке и в уравнительном сосуде к одному уровню и зафиксировать положение уровня воды в бюретке до начала опыта (отсчеты делаются по нижнему краю мениска с точностью до 0,01 мл).
Затем нужно перелить соляную кислоту в то колено пробирки, где находится цинк. Выделяющийся в результате реакции цинка с кислотой водород вытесняет из бюретки в уравнительный сосуд воду. Уравнительный сосуд (4) при этом нужно опускать, сохраняя воду в нем и в бюретке на одном уровне. После окончания реакции, когда прекратится понижение уровня воды в бюретке, следует подождать 5–10 мин, чтобы газ в бюретке принял температуру окружающего воздуха, и отметить положение уровня воды в бюретке после опыта. Записать показания барометра и термометра из табл. 1. Все данные записать в табл.2.
|
Таблица 3 |
Давление паров воды при различных температурах |
|
|
|
Температура |
Давление паров воды, |
|
мм рт. ст. |
0 |
4,6 |
|
|
5 |
6,5 |
|
|
10 |
9,2 |
|
|
16

15 |
12,8 |
|
|
16 |
13,6 |
|
|
17 |
14,5 |
|
|
18 |
15,5 |
|
|
19 |
16,5 |
|
|
20 |
17,5 |
|
|
21 |
18,6 |
|
|
22 |
19,8 |
|
|
23 |
21,1 |
|
|
24 |
22,4 |
|
|
25 |
23,8 |
|
|
26 |
25,2 |
|
|
27 |
26,7 |
|
|
28 |
28,3 |
|
|
29 |
30,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4 |
|
На- |
|
|
|
Условия опыта |
|
Положение уровня |
|
Объем |
|||||||
веска |
|
|
|
|
|
|
|
|
|
|
воды в бюретке |
водорода в |
|||
цинка, |
|
|
|
|
|
|
|
|
|
|
|
|
|
условиях |
|
mZn, г |
Тем- |
Атмосфер- |
|
Давление |
|
До опы- |
После |
опыта, |
|||||||
пера- |
ное давле- |
|
|
паров воды |
|
та, мл |
опыта, |
||||||||
|
|
|
|
VH 2 , мл |
|||||||||||
|
тура, |
|
ние Р, мм |
|
|
при, t C h, |
|
|
|
мл |
|||||
|
t |
C |
|
рт. ст. |
|
|
|
мм рт. ст. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Массу выделившегося водорода рассчитать по формуле Клайперона- |
|||||||||||||||
Менделеева |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
P |
V |
|
|
m( H 2 ) |
RT или m |
|
(P h)V( H 2 )M( H 2 ) |
|||||||
|
|
|
|
|
|
|
|
|
|
, |
|||||
|
( H 2 ) ( H 2 ) |
|
M( H |
|
|
|
( H 2 ) |
|
|
RT |
|
|
|||
|
|
|
|
|
2 |
) |
|
|
|
|
|
|
|
||
где R – универсальная газовая постоянная, равная 62 400 мм рт. ст.мл/моль · град.; Т – абсолютная температура (273 + tºC).
Рассчитать молярную массу эквивалента цинка, пользуясь законом эквивалентов
17

|
m( Zn ) |
М ЭК ( Zn ) |
М ЭК (Zn ) |
m(Zn ) |
||||||
|
|
|
|
|
|
, |
|
. |
||
|
|
|
|
|
|
|||||
|
m( H 2 ) |
М ЭК ( H 2 ) |
|
m( H2 ) |
||||||
Вычислить теоретическое значение молярной массы эквивалента |
||||||||||
цинка и ошибку опыта |
|
|
|
|
|
|
|
|||
Ошибка% |
|
(М ЭК (теор.) М ЭК (опыта ) ) 100 |
||||||||
|
|
|
|
|
. |
|||||
|
|
|
М ЭК (теор.) |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Зарисовать схему прибора в лабораторный журнал.
Задания для самостоятельной работы
1. Вычислить молярную массу эквивалента металла, если при нагревании 0,92 г его в кислороде образуется 1,17 г оксида этого металла.
Ответ: 29,7 г/моль
2. Определить молярные массы эквивалентов кислот и оснований в следующих реакциях:
2HCl + Fe(OH)3 = FeOHCl2 + 2H2О;
KOH + H2S = KHS + H2O;
3H2SO4 + 2Cr(OH)3↓ = Cr2(SO4)3 + 6H2O.
3. При восстановлении 2,17 г оксида марганца алюминием получилось 1,7 г оксида алюминия. Вычислить молярную массу эквивалента марганца и его валентность.
Ответ: 13,7 г
4. Составить графические формулы и дать названия следующим со-
единениям: Ba(NO3)2, Na2CO3, Pb(HSO4)2, K2CrO4, Fe(OH)2NO3, CrOHSO4, Zn2(OH)2SO4.
Тема III. Общие свойства растворов
Растворы – это гомогенные (однородные) системы переменного состава, состоящие из двух или более компонентов.
Растворы могут быть:
твердыми – например, металлические сплавы Au/Ag, Ni/Cu; жидкими – наиболее распространенные – растворы солей и кислот
и щелочей;
18

газообразными – например, воздух: О2 и СО2 и инертные газы в
азоте; Раствор состоит из растворителя и растворенного вещества, напри-
мер, соль в воде: растворитель – вода, растворенное вещество – соль.
I. Энергетические эффекты процессов растворения
Растворение твердых веществ в воде сопровождается поглощением или выделением тепла ( Hраств. – энергия (энтальпия) растворения).
При растворении твердого вещества в воде происходит два процес-
са:
1)разрушение кристаллической решетки, требующее затраты энергии – эндотермический процесс (Eкр. реш . 0);
2)процесс гидратации – взаимодействие частиц растворенного вещества с молекулами растворителя (воды) с образованием гидратирован-
ных частиц – экзотермический процесс (Eгидр. 0).
3)
H раств. = Eкр.реш. – Eгидр.,.
где H раств – энергия (энтальпия) растворения; Eкр.реш – энергия, затрачивающаяся на разрушение кристаллической решетки; Eгидр. – энергия,
выделяемая в процессе гидратации.
Общая энергия растворения в зависимости от того, какой из процессов преобладает, может быть положительной или отрицательной
Если |
Екр.реш. > |
Егидр. |
– растворение происходит с поглощением |
тепла. |
|
|
|
Если |
Екр.реш. < |
Егидр. |
– растворение происходит с выделением те- |
пла. |
|
|
|
Важнейшей количественной характеристикой раствора является его концентрация, показывающая соотношение между количеством растворенного вещества и растворителя. Наиболее часто применяют следующие способы выражения концентраций растворов:
1. Массовая доля – ω выражается в долях единицы или процентах.
m( В)
,
m( р ра)
(%) |
m(В) |
|
|
100% |
|
|
||
m( р ра)
19

где ω – массовая доля;
m(В) – масса растворенного вещества; m(р-ра) – масса раствора,
ω(%) показывает, сколько граммов растворенного вещества содержится в 100 граммах раствора.
Так, раствор серной кислоты с массовой долей 20% показывает, что в 100 граммах раствора содержится 20 грамм серной кислоты и 80 граммов воды.
m(р–ра) = m(В) + m воды
m(р-ра) = ρ · V,
где ρ – плотность мл (г/см3);
V – объем, см3 или дм3 (мл или л).
2. Молярная концентрация вещества См(В)
Это количество моль растворенного вещества В, содержащего в 1 л (дм3) раствора, размерность моль/л (моль/дм3).
Принято пользоваться сокращенной формой записи молярной концентрации. Например, 2М H2SO4 означает раствор, в 1 л которого содержится 2 моля H2SO4, т. е. См (H2SO4)= 2 моль/л.
3. Молярная концентрация эквивалентов вещества В (эквивалентная или нормальная концентрация), (СЭК(В)),
- это количество моль эквивалентов растворенного вещества, содержащегося в 1л раствора, размерность моль экв./л.
Сокращенное обозначение молярной концентрации эквивалентов растворенного вещества принято обозначать н. Так, 2н NaOH означает раствор, в одном литре которого содержится 2 моль эквивалентов гидроксида натрия.
По закону эквивалентов произведение СЭК(В) на объем раствора V(в), в литрах есть величина постоянная
nЭК ( А) nЭК ( В) ,
СЭК ( А)  V ( А) CЭК (В)
V ( А) CЭК (В)  V (В) ,
V (В) ,
где CЭК (A) и CЭК (В) – молярные концентрации эквивалентов первого и второго растворов, а
VA и VB – их объемы.
Пэк(А) и Пэк(в) – количество эквивалентов А и В.
20
