
Методичка по химии
.pdfМолярная концентрация и молярная концентрация эквивалентов связаны соотношением
См(A) · М(A) = CЭК (A) ·МЭК (A).
Растворы в зависимости от содержания растворенного вещества могут быть насыщенными, ненасыщенными и пересыщенными. Насыщенный раствор содержит максимальное количество растворенного вещества при данной температуре и находится в равновесии с осадком. Ненасыщенный раствор содержит меньше растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор содержит больше растворенного вещества, чем в насыщенном растворе и является неустойчивой системой легко переходящей при охлаждении в насыщенный раствор с выделением осадка. Одним из способов приготовления пересыщенного раствора является образование насыщенного раствора при высокой температуре и последующее его охлаждение.
Количественно растворимость вещества определяется концентрацией его насыщенного раствора и выражается в граммах вещества , растворенных в 100 граммах растворителя при данной температуре.
Лабораторная работа 3.
Теплота растворения
Вещества с ионными и полярными связями хорошо растворяются в полярных растворителях, а неполярные вещества – в неполярных растворителях.
Таким образом основное правило растворимости вещества - подобное растворяется в подобном.
В две пробирки налить дистиллированную воду комнатной температуры примерно на 1/4 их объема. Измерить температуру воды и записать ее в журнал. В одной пробирке растворить 2 микрошпателя твердой соли нитрата аммония NH4NO3, а в другой – столько же гидроксида натрия NaOH в виде мелких кусочков. Растворы перемешать стеклянными палочками и тут же измерить их температуру, следя, чтобы шарик термометра при измерениях находился в растворе и не касался стенок пробирки. Записать температуру растворов в журнал. Сделать заключение о тепловых эффектах растворения испытанных веществ.
Теплота гидратации
Для определения теплоты гидратации проводят определение теплоты растворения безводной соли и ее кристаллогидрата CuSO4 и
CuSO4·5H2O.
21
В две сухие пробирки насыпать по 2 микрошпателя измельченного медного купороса CuSO4·5H2O. В одной из пробирок произвести обезвоживание CuSO4·5H2O путем нагревания пробирки с солью до полного перехода голубого цвета соли в светло-серый. Охладить пробирку с обезвоженной солью до комнатной температуры. Налить в обе пробирки одинаковое количество воды комнатной температуры и растворить соли при перемешивании стеклянными палочками. Измерить температуру растворов в обеих пробирках и записать ее в журнал.
Объяснить различие тепловых эффектов при растворении безводного сульфата меди и его кристаллогидрата.
Результаты обоих опытов записать в лабораторный журнал в виде табл. 5.
|
|
|
|
Таблица 5 |
|
|
|
|
|
|
|
Исследуемое |
tºC во- |
tºC |
Энергетический |
Выводы |
|
вещество |
ды |
раствора |
эффект наблю- |
|
|
|
|
|
дения, Hр |
|
|
NH4NO3 |
|
|
|
|
|
NaOH |
|
|
|
|
|
CuSO4·5H2O |
|
|
|
|
|
CuSO4 |
|
|
|
|
|
Опыт 2. Приготовление раствора йода в растворителях с разной полярностью
Взять 4 сухих пробирки. Одну из них на 1/3 заполнить водой, вторую – таким же количеством этилового спирта, третью – бензолом, четвертую – четыреххлористым углеродом. Опустить в каждую из пробирок по одинаковому кристаллу йода и взболтать. В пятую сухую пробирку положить 1–2 кристаллика I2, пробирку закрыть пробкой и осторожно нагреть до сублимации кристаллического I2 (сублимация – переход твердого вещества в газообразное состояние, минуя жидкое). Наблюдать окраску паров I2 и растворов йода в разных растворителях. Наблюдения записать в журнал, отметив причину различной окраски растворов йода. Дать объяснение лучшей растворимости йода в этиловом спирте, чем в воде. Отметить, в каком растворе образуется идеальный раствор йода.
Опыт 3
В стеклянный цилиндр с раствором серной кислоты неизвестной концентрации плавно опустить ареометр так, чтобы он не касался стенок сосуда. По шкале ареометра сделать отсчет плотности раствора H2SO4.
22
По табл. 4 найти соответствующую данной плотности процентную концентрацию раствора H2SO4.
Если замеренная плотность находится между двумя значениями в табл.6, то берется ближайшее значение ρ.
Исходя из найденной массовой доли, рассчитать молярную концентрацию и молярную концентрацию эквивалента раствора
серной кислоты.
Проделать аналогичные определения для растворов веществ по указанию преподавателя.
Таблица 6
Плотность растворов кислот, щелочей и солей при 20оС (г/см3)
Концентрация, |
|
|
|
Плотность |
|
|
|
|
% |
H2SO4 |
HNO3 |
HCl |
KOH |
NaOH |
NaCl |
ZnCl2 |
K2Cr2O7 |
2 |
1,013 |
1,011 |
1,009 |
1,016 |
1,033 |
1,013 |
|
1,0122 |
4 |
1,027 |
1,022 |
1,019 |
1,033 |
1,046 |
1,027 |
|
1,0264 |
6 |
1,040 |
1,033 |
1,029 |
1,048 |
1,06 |
1,041 |
|
1,0408 |
8 |
1,055 |
1,044 |
1,039 |
1,065 |
1,092 |
1,056 |
|
1,0554 |
10 |
1,069 |
1,056 |
1,049 |
1,082 |
1,115 |
1,071 |
|
1,0703 |
12 |
1,083 |
1,068 |
1,059 |
1,100 |
1,137 |
1,086 |
|
|
14 |
1,098 |
1,080 |
1,069 |
1,118 |
1,159 |
1,101 |
|
|
16 |
1,112 |
1,093 |
1,079 |
1,137 |
1,181 |
1,116 |
|
|
18 |
1,127 |
1,106 |
1,083 |
1,156 |
1,213 |
1,132 |
|
|
20 |
1,143 |
1,119 |
1,100 |
1,176 |
1,225 |
1,148 |
1,186 |
|
22 |
1,158 |
1,132 |
1,110 |
1,196 |
1,247 |
1,164 |
|
|
24 |
1,174 |
1,145 |
1,121 |
1,217 |
1,268 |
1,180 |
1,226 |
|
26 |
1,190 |
1,158 |
1,132 |
1,240 |
1,289 |
1,197 |
|
|
28 |
1,205 |
1,171 |
1,142 |
1,263 |
1,310 |
|
1,270 |
|
30 |
1,224 |
1,184 |
1,152 |
1,286 |
1,332 |
|
|
|
32 |
1,238 |
1,198 |
1,163 |
1,310 |
1,352 |
|
1,315 |
|
34 |
1,255 |
1,211 |
1,173 |
1,334 |
1,374 |
|
|
|
36 |
1,273 |
1,225 |
1,183 |
1,358 |
1,395 |
|
1,363 |
|
Проделать аналогичные определения для растворов веществ по указанию преподавателя.
Опыт 4
Кристаллизация из пересыщенных растворов
Сухую пробирку наполнить до 1/5 ее объема кристаллами тетрабората натрия (буры) Na2B4O7·10H2O. Смочить соль пятью каплями воды. Закрепить пробирку в пробиркодержателе и нагреть до полного растворения соли. Полученный раствор охладить на воздухе до комнатной температуры. Отметить отсутствие кристаллизации. В охлажденный раствор буры бросить маленький кристаллик этой соли. Наблюдать ее кристаллизацию. Наблюдаемые явления записать в журнал.
Влияние скорости охлаждения на рост кристаллов
23
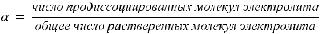
К 1 капле 2н раствора Pb(NO3)2 добавить равный объем 2н раствора KI и 10 капель 2н раствора CH3COOH. К выпавшему осадку прибавить 10 мл воды и нагреть до кипения. Если осадок полностью не растворился, то добавить еще воды и снова нагреть до кипения. Бесцветный раствор разлить в 2 пробирки, нагреть до кипения и одну из них поставить в штатив для медленной кристаллизации, а другую быстро охладить водопроводной водой. Сравнить величину кристаллов PbI2 в обеих пробирках. Наблюдения записать в журнал.
Задания для самостоятельной работы
1. К 500 мл 28%-ного раствора аммиака плотностью 0,9 г/мл прибавили 1 л воды. Какова процентная концентрация аммиака в полученном растворе?
Ответ: 8,69%.
2. Определить молярную концентрацию и молярную концентрацию эквивалентов 20%-ного раствора ортофосфорной кислоты с плотностью
1,1 г/мл.
Ответ: 2,3 М и 6,8 Н.
3. Какой объем 92%-ной H2SO4 с плотностью 1,83 г/мл нужно взять для приготовления 5 литров 0,3н раствора?
Ответ: 43,7 мл.
4. Определить процентную и молярную концентрации раствора HNO3, полученного смешением 0,85 л 60%-ного раствора HNO3 с плотностью 1,373 г/мл и 0,25 л 24,5-ного раствора с плотностью 1,145 г/мл.
Ответ: 53%, 11,1 моль/л.
Тема IV. Электролитическая диссоциация
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. Это соединения с ионной или полярной ковалентной связью: соли, кислоты, основания.
Неэлектролиты – вещества с неполярной ковалентной связью, растворы которых не проводят электрический ток.
Электролической диссоциацией называется распад молекул электролита на ионы (катионы и анионы) в результате их взаимодействия с полярными молекулами растворителя.
Количественно процесс диссоциации характеризуется степенью диссоциации α.
24
Величина α измеряется в долях единицы или процентах и зависит от природы вещества, температуры и концентрации раствора.
Для сильных электролитом α = 1, к ним относятся:
а) неорганические кислоты: HCl, HBr, HI, H2SO4, HNO3 HClO4,
HMnO4, HClO3.
б) основания щелочных и щелочноземельных металлов : LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 и т.д.
в) практически все соли.
Для слабых электролитов (они диссоциируют не полностью) 0<α<1, к ним относятся:
а) остальные неорганические кислоты:HF, HClO, H2S, H2SO3, HNO2,
H2CO3, НСN и т.д.
б) основания: NH4OH, Fe(OH)2, Mg(OH)2 и т.д. , а также все амфо-
терные основания – Zn(OH)2, Al(OH)3, Cr(OH)3, Pb(OH)2, Pb(OH)4,Sn(OH)2, Sn(OH)4, Be(OH)2 и др.
в) все органические кислоты: муравьиная HCOOH, уксусная CH3COOH, щавелевая H2C2O4 и т.д.
г) вода (H2O)
При увеличении температуры и уменьшении концентрации раствора (t° ↑, Cв↓) степень диссоциации возрастает и наоборот
(t° ↓, Cв↑).
Исходя из определения степени диссоциации, можно рассчитать концентрацию ионов электролита в растворе по формуле:
иона
 См(в)
См(в)  n ,
n ,
где [иона] - молярная концентрация иона, - степень диссоциации в долях единицы,
См(в) - молярная концентрация электролита,
n - число ионов на которые распадается молекула электролита. Диссоциация слабого электролита является обратимым процессом и
характеризуется константой химического равновесия, которая для данного случая является константой диссоциации (Кд). Величины, констант диссоциации приведены в таблице 6 и 7.
Константа диссоциации слабой кислоты называется константой кислотности и обозначается Кк . Так для уксусной кислоты, диссоциирующей по уравнению:
CH3COOH H+ + CH3COO-
KK = |
[Н+]·• [CH3COO -] |
= 1,86 • 10-5 |
|
[CH3COOH] |
|||
|
|
25
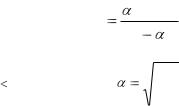
где [H+] и [CH3COO -] - равновесные молярные концентрации ионов, [CH3COOH] - равновесная молярная концентрация непродиссо-
циированных молекул.
Аналогично константа диссоциации слабого основания называется константой основности и обозначается Ко.
Для гидроксила аммония, диссоциирующего по уравнению: NH4OH NH4+OH-
KO = |
[NH4+] • [OH-] |
|
[NH4OH] |
||
|
где [NH4+] и [OH-] - равновесные молярные концентрации ионов. [NH4OH]- равновесная молярная концентрация непродиссоции-
рованных молекул.
Константа диссоциации (Кд) не зависит от концентрации раствора, а определяется природой растворенного вещества и растворителя и зависит от температуры. Чем меньше величина константы диссоциации, тем более слабым электролитом является данное вещество.
Степень и константа диссоциации слабого электролита связаны между собой по закону разбавления Оствальда.
2См(В) К ,
1
где С(в) – молярная концентрация электролита.
Если α< 1, то К= α2·См(в) и |
К |
. |
|
|
|||
С(в) |
|||
|
|
Диссоциация электролитов идет в первую очередь по ионной связи. Сильные кислоты диссоциируют практически полностью и уравне-
ние диссоциации записывается с указанием необратимости процесса.
Например:
HCl → H++Cl-
H2SO4 → 2H+ +SO42-
Слабые кислоты диссоциируют не полностью (в уравнении диссоциации указывается обратимость процесса).
CH3COOH CH3COO- + H+
26
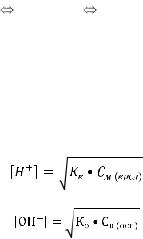
Многоосновные слабые кислоты диссоциируют ступенчато.
H2CO3 H+ HCO3- |
Кк(I) = 4,37*10-7 |
НСО3- H+ + CO32- |
Кк(II) = 5,61*10-11 |
|
Кк(I) > Кк(II) |
Сильные основания диссоциируют практически полностью. NaOH → Na+ + OH-
Ba(OH)2 → Bа2+ +2OH-
Слабые основания диссоциируют незначительно. NH4OH NН4+ + OH-
Cu(OH)2 OH- + CuOH+ CuOH+ Cu2+ + OH-
Амфотерные основания диссоциируют по типу кислоты и основа-
ния.
Кислотный тип |
|
Основной тип |
+3H2O |
|
|
3H+ + [Cr(OH)6]3- |
Cr(OH)3 |
Cr(OH)2+ + OH- |
|
|
↓↑ |
|
|
CrOH2+ + OH- |
|
|
↓↑ |
|
|
Cr3+ + OH- |
Для слабых электролитов, пользуясь численным значением константы кислотности или основности можно вычислить молярные концентрации ионов в растворе
Соли диссоциируют полностью на катионы и анионы.
а) средние соли
FeCl3 → Fe3+ + 3Cl- Al2(SO4)3 → 2Al3+ + 3SO42-
б) кислые соли
Fe(HS)2 → Fe2+ + 2HS- |
α1 |
= 1 |
HS- H+ + S2- |
α2 << 1 |
|
27

в) основные соли |
|
|
CuOHNO3 → CuOH+ + NO3- |
α1 |
= 1 |
CuOH+ Cu2+ +OH- |
α2 << 1 |
|
г) двойные соли |
|
|
FeNH4(SO4)2 → Fe3+ + NH4+ + 2SO42- |
α = 1 |
|
д) комплексные соли |
|
|
Na3[Cr(OH)6] → 3Na+ + [Cr(OH)6]3- |
α1 |
= 1 |
[Cr(OH)6]3- Cr3+ + 6OH- |
α2 << 1 |
|
Для слабых электролитов можно смещать равновесие диссоциации. Направление смещения равновесия определяется принципом Ле-
Шателье (принцип противодействия).
Например:
CH3COOH H+ + CH3COO-
Усиление диссоциации 
Повышение температуры (t°↑) Разбавление раствора (С↓)
Добавление щелочи для связывания ионов водорода в воду.
Подавление диссоциации
Понижение температуры (t°↓) Увеличение концентрации раствора (С↑)
Добавление сильного электролита с одноименным ионом (CH3COONa, HCL и тд.)
Диссоциация воды. Водородный показатель
Вода является слабым электролитом Н2ОН+ + ОН- .
В чистой воде при 25ºС [H+] = [OН-] = 10-7 моль/л. Тогда [H+] · [OН-] = 10-14 (величина постоянная для воды и водных растворов).
Эта величина называется ионным произведением воды.
Отсюда [H+] = 10-14 / [OН-] [OН-] = 10-14 / [H+].
В растворе концентрацию ионов водорода и ионов гидроксила удобнее выражать через водородный показатель рН и гидроксильный показатель рОН
рН = –lg [H+].
pH – отрицательный логарифм от молярной концентрации ионов водорода.
рОН = –lg [OН-].
28
Для нейтральной среды рН=7, для кислой рН<7, для щелочной рН>7.
При логарифмировании ионного произведения воды получим рН + рОН = 14.
Лабораторная работа 4. Сравнение химической активности ки-
слот
Реакции обмена
Водну пробирку внести 7–8 капель 2н раствора HCl, в другую
столько же 2н раствора CH3COOH и опустить в них по небольшому, но одинаковому кусочку мела – CaCO3. Наблюдать выделение газа. В какой из пробирок газ выделяется более бурно? От чего зависит скорость выделения газа? Написать молекулярные и ионные уравнения реакций, сделать вывод об относительной силе исследованных кислот.
Реакции замещения
Водну пробирку внести 10–12 капель 2н раствора CH3COOH, в другую – столько же 2н раствора HCl. Бросить в каждую пробирку по одинаковому кусочку цинка (поверхность цинка зачистить). Отметить, в каком случае водород выделяется более интенсивно. Написать молекулярные и ионные уравнения реакций. Объяснить наблюдаемое различие в скоростях реакций.
Опыт 2. Получение и свойства гидроксидов металлов
В одну пробирку внести 2–3 капли 2н раствора соли Cr(NO3)3, в другую – столько же 2н раствора соли FeСl3. В обе пробирки прибавить по 5–7 капель 2н раствора NH4OH. Наблюдать выпадение в осадок гидроксидов Cr(OH)3 и Fe(OH)3. Отметить их цвет. Разделить содержимое каждой из пробирок на две пробирки. К осадкам гидроксидов прилить в одном случае по 5–6 капель 2н раствора НСl, а в другом – по 5–6 капель 2н раствора NaOH. Наблюдать происходящие явления и отметить цвета полученных продуктов реакций.
Сделать заключение о химическом характере гидроксидов Cr(OH)3 и
Fe(OH)3.
Написать молекулярные и ионные уравнения всех реакций, принимая во внимание, что в щелочном растворе гидроксид хрома (III) образу-
ет ион [Cr(OH)6)]3-.
Опыт 3. Смещение равновесия в растворах уксусной кислоты и аммиака.
В 2 пробирки внести по 5–7 капель 2н раствора CH3COOH и по одной капле индикатора метилоранжа. В одну из пробирок прибавить немного кристаллического ацетата натрия и содержимое перемешать встря-
29
хиванием, вторую – оставить для сравнения. Наблюдать, как изменилась окраска индикатора при добавлении NaCH3COO. Написать уравнение диссоциации CH3COOH и объяснить причину изменения цвета раствора и направление сдвига равновесия диссоциации, исходя из принципа ЛеШателье.
Какой электролит нужно добавить к раствору CH3COOH, чтобы вызвать сдвиг равновесия диссоциации в противоположном направлении? Как изменяется в обоих случаях степень диссоциации уксусной кислоты? Будет ли происходить при этом изменение константы диссоциации?
Сдвиг равновесия в растворе NH3
В 2 пробирки внести по 5–7 капель 2н раствора NH3 и по 1 капле индикатора фенолфталеина. Добавить в одну из пробирок немного кристаллического хлорида аммония и содержимое пробирки перемешать встряхиванием. Сравнить окраску растворов в пробирках. В одном рас-
творе NH3 существует следующее равновесие:
NH3↑ + H2O NH3 · H2O ↔ NH4+ + OH-.
Объяснить направление сдвига равновесия в водном растворе NH3 в присутствии NH4Cl.
Опыт 4.Ионные реакции в растворах электролитов
В три пробирки налить по 2–3 капли 2н раствора соли нитрата свинца(II). Добавить в первую пробирку 4–5 капель 2н раствора серной кислоты, во вторую – 4–5 капель 2н сульфата натрия, в третью – 4–5 капель 2н сульфата аммония. Написать молекулярные и ионные уравнения реакции. Каким сокращенным ионным уравнением можно записать три реакции?
Опыт 5. Приближенное определение рН растворов при помощи универсального индикатора
Универсальная индикаторная бумага используется для определения рН раствора. По прилагаемой к ней цветной шкале устанавливают, при каких значениях рН индикаторная бумага окрашивается в тот или иной цвет.
Нанести каплю 2н раствора HCl на полоску бумажки с универсальным индикатором. Сравнить окраску полученного пятна с цветовой шкалой универсального индикатора. Записать соответствующую величину рН.
Проделать то же самое с растворами уксусной кислоты, едкого натра, водного раствора аммиака. По значениям рН рассчитать концентрацию ионов водорода и ионов гидроксила. Результаты записать в табл. 7.
30
