
- •Момент инерции (определение, единицы измерения). Моменты инерции цилиндра, шара и стержня относительно оси вращения, проходящей через ось симметрии.
- •Вращательное движение твердого тела с закрепленной осью вращения. Основной закон динамики вращательного движения. Теорема Штейнера.
- •Криволинейное движение. Радиус кривизны траектории. Нормальное, тангенциальное, полное ускорение материальной точки.
- •Закон всемирного тяготения (формула Ньютона). Постоянная тяготения (величина, единицы измерения).
- •Связь линейной и циклической частоты. Связь периода гармонических колебаний с циклической частотой.
- •Центр масс системы материальных точек. Закон сохранения импульса системы материальных точек. Принцип реактивного движения.
- •Кинетической энергией системы называется скалярная величина w, равная арифметической сумме кинетических энергий всех точек системы
- •Математический маятник. Частота колебаний математического маятника (формула).
- •Линейная скорость материальной точки, линейное ускорение материальной точки, единицы измерения. Сложение скоростей.
- •Свободные колебания. Пружинный маятник. Частота колебаний пружинного маятника (формула).
- •Первый закон термодинамики для изобарного процесса.
- •Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
- •Гармонические колебания. Амплитуда, фаза, циклическая частота гармонических колебаний, единицы измерения.
- •Работа постоянного тока на участке цепи. Закон Джоуля - Ленца.
- •Постоянная Больцмана, её величина, размерность, физический смысл.
- •Правила Кирхгофа. (для электрических цепей, содержащих несколько источников эдс)
- •Среднеквадратичная скорость молекул газа.
- •Колебательная система
- •Напряженность поля точечного заряда
- •Разность потенциалов между двумя точками электростатического поля.
- •Первый закон термодинамики для изотермического и адиабатического процессов.
- •Среднеквадратичная скорость
- •Электрический ток. Сила электрического тока, единицы измерения.
- •Эквипотенциальные поверхности. Эквипотенциальные поверхности для точечного электрического заряда.
- •Поляризация диэлектрика. Напряженность электростатического поля внутри диэлектрика.
- •Реакция деления ядра. Термоядерная реакция (реакция термоядерного синтеза).
- •Закон Ома для участка цепи:
- •Цепная ядерная реакция. Критическая масса радиоактивного элемента
- •Волновая функция (физический смысл).
-
Разность потенциалов между двумя точками электростатического поля.
Так
как потенциальная энергия ![]() ,
то работа сил поля равна:
,
то работа сил поля равна:
![]()
Здесь
![]()
- разность потенциалов, т. е. разность значений потенциала в начальной и конечной точках траектории. Разность потенциалов называют также напряжением. Согласно формулам (14.17) и (14.18) разность потенциалов между двумя точками оказывается равной:
![]()
Разность потенциалов (напряжение) между двумя точками равна отношению работы поля при перемещении положительного заряда из начальной точки в конечную к величине этого заряда. Если за нулевой уровень отсчета потенциала принять потенциал бесконечно удаленной точки поля, то потенциал в данной точке равен отношению работы электростатических сил по перемещению положительного заряда из данной точки в бесконечность к этому заряду. Единица разности потенциалов. Единицу разности потенциалов устанавливают с помощью формулы (14.19). В Международной системе единиц работу выражают в джоулях, а заряд - в кулонах. Поэтому разность потенциалов между двумя точками численно равна единице, если при перемещении заряда в 1 Кл из одной точки в другую электрическое поле совершает работу в 1 Дж. Эту единицу называют вольтом (В); 1 В = 1 Дж/1 Кл.
Работа
поля по перемещению заряда из одной
точки в другую, называется разностью
потенциалов
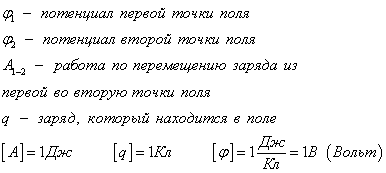
-
Первый закон термодинамики для изотермического и адиабатического процессов.
![]() Согласно
первому закону термодинамики, изменение
внутренней энергии термодинамической
системы при переходе из одного состояние
в другое равно сумме работы, выполненной
внешними силами, и количества теплоты,
переданной системе извне
Согласно
первому закону термодинамики, изменение
внутренней энергии термодинамической
системы при переходе из одного состояние
в другое равно сумме работы, выполненной
внешними силами, и количества теплоты,
переданной системе извне

Сформулировать первый закон термодинамики можно иначе: количество теплоты, получаемое системой извне при ее переходе из одного состояния в другое, расходуется на повышение внутренней энергии системы и на работу, которую она выполняет против внешних сил
![]()

При изотермическом
процессе температура
не изменяется, значит не изменяется внутренняя
энергия ![]()
Первый
закон принимает вид ![]()
Все количество теплоты, которую получает газ расходуется на выполнение им работы против внешних сил. Или, если газ сжимается, при этом не изменяется температура, работу выполняют внешние силы, а газ отдает некоторое количество теплоты в окружающую среду.
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид
|
т. е. газ совершает работу за счет убыли его внутренней энергии.
-
Среднеквадратичная скорость. Наиболее вероятная скорость молекул.
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул
![]()
Среднеквадратичная скорость
Вывод
формулы начинается с основного уравнения
молекулярно кинетический теории
(МКТ):![]()
Где ![]() у
нас количество вещества, для более
легкого доказательства, возьмем на
рассмотрение 1 моль вещества, тогда у
нас получается:
у
нас количество вещества, для более
легкого доказательства, возьмем на
рассмотрение 1 моль вещества, тогда у
нас получается:
![]() Если
посмотреть, то PV это две третьих средней
кинетической энергии всех молекул (а у
нас взят 1 моль молекул):
Если
посмотреть, то PV это две третьих средней
кинетической энергии всех молекул (а у
нас взят 1 моль молекул):
![]() Тогда,
если приравнять правые части, у нас
получается, что для 1 моля газа средняя
кинетическая энергия будет равняться:
Тогда,
если приравнять правые части, у нас
получается, что для 1 моля газа средняя
кинетическая энергия будет равняться:
![]() Но
средняя кинетическая энергия, так же
находится, как :
Но
средняя кинетическая энергия, так же
находится, как :![]()
А
вот теперь, если мы приравняем правые
части и выразим из них скорость и возьмем
квадрат,Число Авогадро на массу молекулы
, получается Молярная масса ![]() то
у нас и получится формула для средней
квадратичной скорости молекулы газа:
то
у нас и получится формула для средней
квадратичной скорости молекулы газа:![]()
А
если расписать универсальную газовую
постоянную, как ![]() ,
и за одно молярную массу
,
и за одно молярную массу ![]() ,
то у нас получится?
,
то у нас получится?
![]()
В Формуле мы использовали :
![]() —
Средняя
квадратичная скорость молекул,
—
Средняя
квадратичная скорость молекул,
![]() — Постоянная
Больцмана
— Постоянная
Больцмана
![]() —
Температура,
—
Температура,
![]() —
Масса одной молекулы,
—
Масса одной молекулы,
![]() — Универсальная
газовая постоянная
— Универсальная
газовая постоянная
![]() —
Молярная
масса,
—
Молярная
масса,
![]() —
Количество вещества,
—
Количество вещества,
![]() —
Средняя кинетическая энергия молекул,
—
Средняя кинетическая энергия молекул,
![]() — Число
Авогадро
— Число
Авогадро
-
Три эквивалентные формулы для энергии конденсатора.
Формулу для энергии заряженного конденсатора можно записать в нескольких эквивалентных формах:


-
Формула работы для элементарного квазистационарного процесса. Геометрическое изображение работы в координатах PV.
-
Планетарная модель атома (модель Резерфорда).
Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны (рис. 6.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
|
|
-
Как изменяется температура и энтропия идеального газа при адиабатическом сжатии?
Адиаб.процесс-процесс, происход. без обмена теплотой с окружающей средой. Q=0, U=-A., слеовательно энтропия не изменяется, так как нет обмена с окрж.средой S=Q/T
Нагревание газа при адиабатическом сжатии объясняется тем, что во время сжатия над газом производится работа, которая идёт на увеличение его внутренней энергии. А так как внутренняя энергия идеального газа зависит только от температуры, то это увеличение внутренней энергии проявляется в повышении его температуры - средней кинетической энергии неупорядоченного движения молекул. На микроскопическом уровне это означает, что когда поршень сжимает газ, скорость, с которой молекула отразится от поршня, будет больше её начальной скорости. Поэтому при отражении от поршня она получит дополнительную энергию, которая постепенно перераспределится между всеми молекулами газа за счёт их взаимных столкновений.

