
_3_1-1
.pdf
71
РАБОТА 10 ОПРЕДЕЛЕНИЕ ПОТЕНЦИАЛА ИОНИЗАЦИИ АТОМА ВОДОРОДА
Приборы и принадлежности: заполненная водородом лампа, вольтметр, амперметр, источник питания.
Цель работы: экспериментальная проверка наличия дискретных стационарных состояний и определение потенциала ионизации атома водорода.
Описание установки и метода измерений. Постулаты Бора о существовании стационарных состояний атома и квантованности энергии, которую испускает (поглощает) атом при переходе из одного стационарного состояния в другое, были экспериментально подтверждены в опытах Франка и Герца, в которых исследовались механизмы взаимодействия электронов, ускоренных полем, с атомами различных газов (первые опыты были проведены с парами ртути). Схема экспериментальной установки в опытах Франка и Герца приведена на рис. 36.
Рис. 36
Вакуумная трубка, содержащая катод К, сетку S и анод А, заполнялась инертным газом при низком давлении. Испускаемые с катода К за счет термоэлектронной эмиссии электроны ускорялись разностью потенциалов U , приложенной между сеткой и катодом. При этом за счет небольшого отрицательного потенциала анода относительно сетки (0.5 В) между точками S и А схемы создавалось тормозящее электрическое поле.
Электроны, сталкиваясь с атомами исследуемого газа, могут испытывать как упругое, так и неупругое рассеяние. При упругом столкновении кинетическая энергия электронов не изменяется; в результате неупругого взаимодействия атомы поглощают определенную часть кинетической энергии электронов и переходят в возбужденное состояние, которому соответствует большее значение их полной энергии.
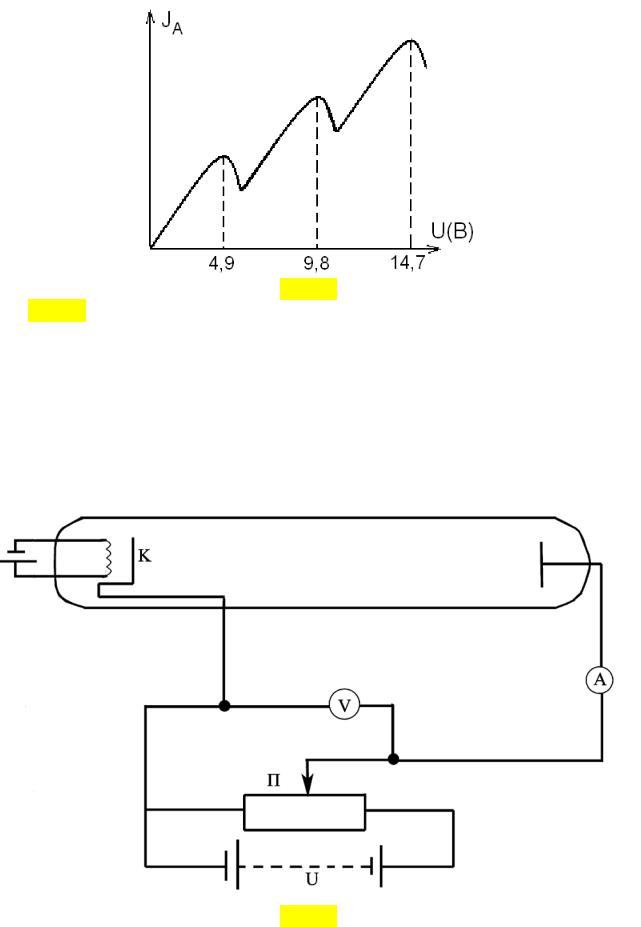
Согласно постулатам Бора, поглощенная энергия равна разности энергий в двух стационарных состояниях атома. В частности, для атома ртути полная энергия первого возбужденного состояния превышает энергию основного стационарного состояния на 4.86 эВ. Таким образом, при разности потенциалов между сеткой и катодом в 4.9 В электрон, взаимодействуя с атомом ртути,
72
полностью передает ему свою кинетическую энергию и при наличии тормозящего поля между сеткой и анодом не достигает последнего.
Рис. 37 На рис. 37 представлена полученная в опытах Франка и Герца зависимость
силы тока, проходящего через трубку, от разности потенциалов между катодом
исеткой. Подобный ход кривой I A (U ) объясняется дискретностью
энергетических состояний атомов и является подтверждением основных положений Боровской теории атома.
Постулаты Бора убедительно подтверждаются также при исследовании потенциалов ионизации атомов.
Рис. 38
73
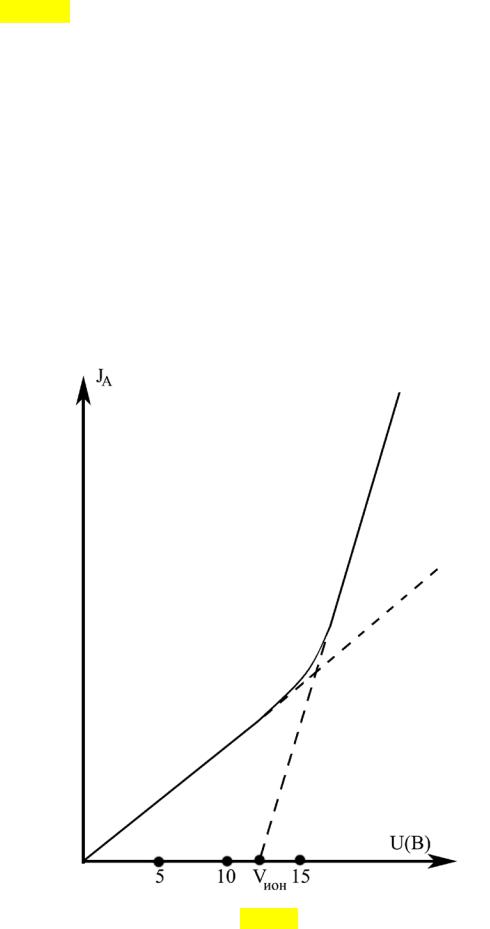
На рис. 38 представлена схема экспериментальной установки для определения потенциала ионизации атомов водорода, которая включает наполненную водородом газоразрядную трубку, содержащую нагреваемый катод К и анод А, а так же вольтметр, амперметр, источник постоянного напряжения U и реостат П.
Известно, что при увеличении положительного потенциала анода относительно катода от нуля до нескольких вольт, сила тока увеличивается пропорционально прикладываемой разности потенциалов в степени 3/2. Однако по мере увеличения разности потенциалов, начиная с определенного значения последней, наблюдается более значительное возрастание силы тока (рис. 39). Это объясняется тем, что при данном значении разности потенциалов кинетическая энергия электронов пучка оказывается достаточной для перевода электронов атома водорода с ближайшей к ядру орбиты (основное состояние атома n =1) на орбиту с n = ∞ (свободное состояние электрона). Таким образом, в газоразрядной трубке появляются дополнительные свободные электроны.
Рис. 39

74
Образование дополнительных носителей тока и обуславливает представленную на рис. 39 зависимость I A (U ) . Эта разность потенциалов носит
название “потенциал ионизации”, и для атома водорода составляет 13.6 В, что хорошо согласуется со значением 13.6 эВ, рассчитанным по формуле (1) при
n =1, m = ∞ :
|
1 |
|
1 |
(1) |
|
∆Е = сRh |
|
− |
|
|
|
|
|
||||
n2 |
|
m2 |
|
||
c = 2.998 108 м/ c – скорость света в вакууме, |
R =1.097 107 м−1 – постоянная |
||||
Ридберга, h = 6.62 10−34 Дж с – постоянная Планка.
Порядок выполнения работы.
1.Ручку потенциометра П (см. рис. 38) установить в крайнее левое положение.
2.Включить установку в сеть и выждать 2-3 мин.
3.Регулируя ручкой потенциометра П разность потенциалов между катодом
ианодом газоразрядной трубки и измеряя по шкале миллиамперметра силу
тока, снять зависимость I A (U ) с шагом 0.5 В. Р езультаты измерений занести в
таблицу. Таблица *.
U , (В)
I A , (mА)
*) Число столбцов в таблице должно быть максимально возможным с учётом шага по напряжению.
4. На основе полученных данных построить график зависимости I A (U ) . По
графику определить значение потенциала ионизации атома водорода (см. рис.
39).
5. Записать классы точности используемых в установке приборов и диапазоны измерений. Определить приборную погрешность измерений ∆U = k Uд/100 , где k – класс точности вольтметра, а Uд - предельные значения
его |
|
шкалы. |
Полученный |
результат |
представить |
в |
виде: |
Uион = |
|
ион ± ∆U . |
|
|
|
|
|
U |
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ.
1.Чем отличаются два рассмотренных в работе эксперимента.
2.Почему результаты опытов Франка и Герца подтверждают наличие у атомов дискретных энергетических уровней?
3.Что называется потенциалом ионизации данного атома?
4.Чем отличается понятие потенциала ионизации и потенциала возбуждения какого-либо атома?
75
РАБОТА 11 ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА ПО СПЕКТРУ АТОМА
ВОДОРОДА
Приборы и принадлежности: универсальный монохронометр УМ-2, блок источников света, содержащий водородную, ртутную, неоновую и натриевую газоразрядные лампы, ахроматический конденсор.
Цель работы: изучение закономерностей, наблюдаемых в видимой части спектра испускания атома водорода, и определение постоянной Ридберга.
Описание установки и метода измерений. В соответствии с постулатами Бора при переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон. Излучение фотона происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией, при этом энергия фотона равна разности энергий в двух состояниях атома
hν = Em − En , |
(1) |
где n,m – два значения главного квантового числа, |
ν – частота, h – |
постоянная Планка. |
|
Из теории следует, что энергия атома водорода, находящегося в стационарном состоянии, характеризующемся значением главного квантового числа n, равна
En = − |
m e4 |
|
|
(2) |
e |
|
|
||
2 2 |
2 |
|
||
|
8h ε0 n |
|
|
|
где me – масса покоя электрона, e – заряд электрона, n |
– целое число (о |
|||
наборе квантовых чисел, полностью характеризующих состояние электрона в поле атомного ядра).
С учетом выражения (2) формула (1) может быть представлена в виде
|
|
1 |
|
|
1 |
|
, |
|
|
|
(3) |
||||
|
|
ν = cR |
|
|
− |
|
|
|
|
|
|
|
|||
|
|
|
|
|
m2 |
|
|
|
|||||||
где |
|
n2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R = |
|
m e4 |
|
|
|
|
|
(4) |
|||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|
|||
|
|
|
|
8h ε0 c |
|
|
|
|
|
|
|||||
- постоянная |
Ридберга; |
c = 2.998 108 м/ с- |
|
скорость |
света |
в |
вакууме; |
||||||||
me = 9.11 10−31 кг - |
масса покоя |
электрона; |
|
|
|
e =1.6 10−19 Кл |
- |
заряд |
электрона; |
||||||
h = 6.63 10−34 Дж с |
- постоянная Планка; |
|
ε0 = 8.85 10−12Ф/ м |
- |
электрическая |
||||||||||
постоянная.
Таким образом, частоты ν в дискретном линейчатом спектре атома водорода описываются соотношением (3), которое называется формулой

76
Бальмера - Ридберга. Учитывая, что ν = c / λ , выражение (3) можно записать в виде
1 |
|
1 |
|
1 |
(5) |
|
|
= R |
|
− |
|
|
|
λ |
|
m2 |
||||
n2 |
|
|
|
|||
При этом, значения главного квантового числа таковы, что m = n +1, n +2 ,… и
т.д.
Группа линий с одинаковым числом n называется серией. В спектре излучения атома водорода наблюдаются следующие серии (рис. 40): n =1 -
серия Лаймана; n = 2 - |
серия Бальмера; |
n = 3 - серия |
Пашена и т.д. Все линии |
серии Лаймана лежат в ультрафиолетовой области |
спектра. Первые четыре |
||
линии Бальметровской |
серии (n = 2 , |
m =3, 4, 5, 6 ) лежат в видимой области |
|
спектра. |
|
|
|
Рис. 40
Вданной работе осуществляется экспериментальная проверка соотношения
(5)для спектра излучения атома водорода и определяется значение постоянной Ридберга.
Порядок выполнения работы.
Задание 1. Градуировка монохроматора по спектральным линиям неона (ртути).
Внимание: В колбе работающей ртутной лампы давление достигает 30 атм. Вскрывать кожух лампы запрещается. Лампа ртути испускает интенсивное ультрафиолетовое излучение. Лампу включать на время не более 20 минут.
Градуировочный график отражает зависимость между длиной волны попадающих в перекрестие окуляр-микрометра лучей и делениями шкалы барабана. Для проведения градуировки необходимо следующее.

77
1.Включить в сеть монохронометр.
2.Включить неоновую (ртутную) лампу соответствующим тумблером на блоке источников света 1 (рис. 41).
3.Получить четкое изображение всех линий видимого спектра неона (ртути)
вокуляр-микрометре. При этом:
а) с помощью рукоятки 3 поставить зеркало 2 в положение, соответствующее максимальной освещенности щели 5;
Рис. 41
б) перемещая конденсор 4 в горизонтальной плоскости сфокусировать свет лампы по центру входной щели монохроматора;
в) регулируя винтом 6 ширины входной щели и маховичком 9 положение объектива 10, добиться четкого изображения одной из спектральных линий в поле зрения окуляра 11;
4. Вращая барабан 8 совместить перекрестие окуляр - микрометра с красной линией неона (ртути). Записать показания шкалы барабана, соответствующие этому положению в табл. 1. Занести в таблицу 1 соответствующую этой линии длину волны, которая определяется по данным рис. 42.
Таблица 1.
№ |
Описание линий спектра: |
Длина λ |
Деления |
линии |
цвет, номер линии в группе |
волны |
шкалы барабана, |
п\п |
одного цвета |
выбранной |
град. |
|
|
линии в (Å) |
|
1.
…
n*
*) Число строк n в таблице равно числу линий наблюдаемых в спектре.
5.Повторить п. 4 для всех видимых линий спектра неона (ртути).
6.Выключить неоновую (ртутную) лампу.
7.Построить градуировочный график монохроматора: на ось абсцисс нанести показания шкалы монохроматора в градусах, на ось ординат - соответствующие им значения длин волн в ангстремах.

78
Рис. 42 Задание 2. Определение постоянной Ридберга.
1.Включить водородную лампу.
2.Получить четкое изображение спектра в соответствии с пунктом 3 задания 1.
3.Установить перекрестие окуляр - микрометра на красную линию водородного спектра. Занести в табл. 2 соответствующее значение отсчета по шкале барабана.
4.Повторить пункт 3 для второй линии спектра (зелено-голубая), затем для третьей (фиолетовая линия).
Примечание: Измерение проводить только для указанных линий, т.к. между ними находиться слабые по интенсивности линии молекулярного спектра водорода.
5.По градуировочному графику найти длины волн, соответствующие трем указанным линиям. Полученные значения занести в таблицу 2.
6.Подставить в формулу Бальмера - Ридберга (3) полученные значения
длин волн и соответствующие им квантовые числа (n = 2 , m =3, 4, 5 ) и для
каждой из указанных линий вычислить значение постоянной Ридберга. Результаты вычислений занести в табл. 2.
Таблица 2.

79
№ |
Описание линий |
Длина λ |
Деления |
R |
< R |
линии |
спектра |
волны линии, |
шкалы, в φ |
|
> |
п\п |
|
в (Å) |
(град.) |
|
|
1. |
красная |
|
|
|
|
2. |
зелено-голубая |
|
|
|
|
3. |
фиолетовая |
|
|
|
|
7. Найти среднее значение постоянной Ридберга и определить погрешность для значения коэффициента надежности 0.68. Результат обработки данных представить в виде
R = R ± ∆R .
Полученные значения постоянной Ридберга сравнить с рассчитанными по формуле (4).
КОНТРОЛЬНЫЕ ВОПРОСЫ.
1.Сформулируйте постулаты Бора.
2.Почему нельзя объяснить закономерности, наблюдаемые в спектре атома водорода, исходя из представлений классической физики?
3.Определите наименьшую и наибольшую длины волн в серии Бальмера.
4.Набор каких квантовых чисел полностью характеризует состояние одного электрона в поле атомного ядра?
80
РАБОТА 12
ОПРЕДЕЛЕНИЕ УПРУГИХ ПАРАМЕТРОВ ГОРНЫХ ПОРОД С ПОМОЩЬЮ УЛЬТРАЗВУКОВЫХ ВОЛН
Введение. Горными породами называют природные агрегаты минералов более или менее постоянного минералогического и химического состава, образующие самостоятельные геологические тела, слагающие земную кору. Форма, размеры и взаимное расположение минеральных зёрен обуславливают структуру и текстуру горных пород. Для определения упругих параметров горных пород широко применяют акустические методы – исследование внутренней структуры вещества с помощью звуковых или ультразвуковых волн.
Ультразвуковыми волнами (УЗ - волнами, ультразвуком) называют упругие волны с частотами приблизительно от (1.5÷2)×104 Гц (15÷20 кГц) до 109 Гц (1 ГГц); область частот упругих волн от 109 Гц до 1012÷1013 Гц принято называть гиперзвуком. По частоте ультразвук подразделяют на три диапазона: ультразвук низких частот (1.5×104÷107 Гц), ультразвук средних частот (105÷107 Гц), область высоких частот ультразвука (107÷109 Гц). Каждый из этих диапазонов характеризуется специфическими особенностями генерации, приёма, распространения и применения.
По физической природе ультразвук представляет собой упругие волны, и в этом он не отличается от звука, поэтому частотная граница между звуковыми и УЗ - волнами условна. Однако благодаря более высоким частотам и, следовательно, малым длинам волн имеет место ряд особенностей распространения ультразвука.
Ввиду малой длины волны ультразвука характер его распространения определяется в первую очередь молекулярной структурой среды, поэтому,
измеряя скорость с и коэффициент затухания α, можно судить о молекулярных свойствах вещества. Жидкости и твёрдые тела (особенно монокристаллы) представляют собой хорошие проводники ультразвука, затухание в них мало. Поэтому области использования ультразвука средних и высоких частот относится почти исключительно к жидкостям и твёрдым телам, а в воздухе и газах применяют только ультразвук низких частот.
Ультразвук играет большую роль в изучении структуры вещества. Наряду с методами молекулярной акустики для жидкостей и газов, измерение скорости с
икоэффициента затухания α используется для определения модулей упругости
идиссипативных характеристик твёрдых тел.
Скорость распространения ультразвуковых волн в различных средах
Скорость распространения ультразвуковых волн (c ) в газах определяется по формуле Лапласа, если амплитуда колебаний сравнительно мала:
