
Аденилатциклазная система
При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул – гормонов и нейромедиаторов.
Функционирование системы трансмембранной передачи сигналов обеспечивают 5 белков.

-
Интегральные белки цитоплазматической мембраны: Rs-рецептор активатора аденилатциклазной системы и Ri-рецептор ингибитора аденилатциклазной системы
-
Фермент аденилатциклаза
-
«заякоренныве белки»: Gs-ГТФ-связывающий белок, состоит из αs, β,γ -субъединиц и Gj-ГТФ-связывающий белок, состоит из αi, β,γ -субъединиц и одного цитозольного фермента протеинкиназы А (ПКА).
Последовательность событий, приводящих к активации аденилатциклазы:
Рецептор имеет два центра связывания: для гормона на наружной поверхности мембраны и для G-белка на внутренней поверхности мембраны.
-
Взаимодействие активатора аденилатциклазной системы, например гормона с рецептором (Rs), приводит к изменению конформации рецептора
-
Увеличивается сродство рецептора к Gs-белку. Образуется комплекс гормон-рецептор.
-
Присоединение комплекса гормон-рецептор к Gs-ГДФ снижает сродство α-субъединицы Gs-белка к ГДФ и увеличивает сродство к ГТФ. В активном центре αs-субъединицы ГДФ замещается на ГТФ;
-
Это вызывает изменение конформации αs-субъединицы и снижение сродства к βγ-субъединицам
-
Отделившаяся αs-ГТФ субъединица латерально перемещается в липидном слое мембраны к центру связывания фермента аденилатциклазы
-
Взаимодействие αs- ГТФ субъединицы с аденилатциклазой приводит к изменению конформации фермента, его активации и увеличению скорости образования цАМФ из АТФ;
-
В клетке повышается концентрация цАМФ – вторичного посредника гормонального сигнала
-
Молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами протеинкиназы А, которая состоит из 2 регуляторных и 2 каталитических субъединиц
-
Присоединение цАМФ к регуляторным субъединицам вызывает диссоциацию комплекса, каталитические субъединицы отделяются и становятся активными
-
Активная протеинкиназа А с помощью АТФ фосфорилирует специфические
белки по серину и треонину, в результате изменяются конформация и активность
фосфорилированных белков, а это приводит к изменению скорости и направления
регулируемых ими процессов в клетке.
Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая рецептор, может "включать" несколько G-белков, и затем каждый активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 102-103 раз. Образующийся цАМФ "включают" другой фермент - протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой А ещё больше усиливает сигнал, в результате суммарное усиление равно 106-107 раз. Таким образом, по механизму каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул.
Инозитолфосфатная система
Инозитолфосфатная система включает 3 мембранных белка:
-
R- рецептор активатора инозитолфосфатной системы – интегральный белок
-
Фосфолипаза С - поверхностный белок
-
Gplc – ГТФ-связывающий белок активирует фосфолипазу С – заякоренный белок
Работу системы обеспечивают белок кальмодулин, фермент протеин киназа С, регулируемые Са2+ -каналы мембраны ЭПР, Са2+ -АТФаза клеточной и митохондриальной мембран
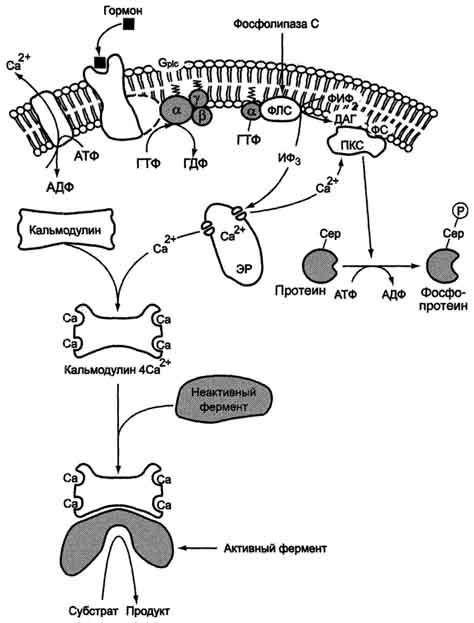
Последовательность событий, приводящих к активации фосфолипазы С:
-
связывание сигнальной молекулы, например гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Gр1с-белку.
-
образование комплекса гормон-рецептор Gрlс-ГДФ приводит к снижению сродства αрlс-протомера Gрlс-белка к ГДФ и увеличению сродства к ГТФ. В активном центре αрlс-субъединицы ГДФ заменяется на ГТФ.
-
это вызывает изменение конформации αрlс-субъединицы и она отделяется от βγ-
субъединицы
-
отделившаяся α- ГТФ субъединица латерально перемещается по мембране к центру связывания фермента фосфолипазы С.
-
взаимодействие α- ГТФ субъединицы с фосфолиггазой С изменят конформацию и активность фермента, увеличивается скорость гидролиза фосфолипида клеточной мембраны фосфатидилинозитол-4,5-бисфосфата (ФИФ2).
-
в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС).
-
инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2+-канала мембраны ЭР, это приводит к изменению конформации белка и открытию Са2+-канала. Са2+ по градиенту концентрации поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
