
- •2.Химические реакции, фазовые и структурные превращения. Основные типы и классы химических соединений.
- •3.Классы неорганических соединений. Химические и структурно-графические формулы, способы получения соединений.
- •4.Стехиометрические законы (шесть) и их современное толкование.
- •5. Химический эквивалент элемента, оксида, гидроксида и соли. Молярная масса эквивалента, молярный объём эквивалента газа. Общая и частные формулы закона эквивалентов.
- •6.Строение атома. Ядро и электроны, протоны и нейтроны, их заряд и масса. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Представление об атомных спектрах.
- •7. Корпускулярно-волновая природа движущихся микрочастиц. Уравнение де Бройля. Принцип неопределенности. Понятие о волновой функции и атомной орбитали. Квантовые числа электронов в атоме.
- •9. Периодический закон и система элементов д.И. Менделеева, их развитие и значение. Закон Мозли. Структура периодической системы и её связь со строением атомов. Электронные аналоги.
- •10. Периодичность физических и химических свойств элементов. Энергия ионизации, сродство к электрону, электроотрицательность, атомный радиус.
- •12. Метод валентных связей. Гибридные орбитали и связи. Валентные углы. Строение молекул BeF2, BeF3, cCl4, sf6, h2o и nh3.
- •13. Кратность (порядок) связи. Сигма- и Пи-связи, схемы перекрывания атомных орбиталей и прочность связей. Полярные связи и молекулы.
- •15. Энергетические диаграммы образования молекул n2 и o2. Кратность связи и магнитные свойства.
- •16. Ионная связь и её свойства. Строение ионных кристаллов типа CsCl, NaCl, ZnS (сфалерит) и CaF2 (флюорит).
- •17. Металлическая связь и её свойства. Кристаллические структуры металлов типа вольфрама, меди и магния. Координационные числа и плотность упаковки атомов.
- •19. Агрегатные состояния вещества и их характеристика. Плазма. Стекла и аморфные вещества. Понятие о ближнем и дальнем порядках.
- •20. Энергетический (тепловой) эффект изохорного и изобарного химических процессов. Стандартная энтальпия образования химического соединения. Закон Гесса и следствия из него.
- •21. Энтальпийные диаграммы и энергия химической связи в молекулах газов типа hcl, nh3, no.
- •22. Понятие об энтропии. Стандартный энтропийный эффект химической реакции и фазового превращения. Энтальпийный и энтропийный факторы процесса.
- •23. Направление химической реакции. Понятие о свободной энергии Гиббса и её изменении как движущей силы изобарного процесса. Стандартное изменение энергии Гиббса при химической реакции.
- •24. Скорость гомогенной реакции. Средняя и истинная скорость реакции. Закон действия масс. Константа скорости реакции. Понятие о молекулярности и порядке реакции.
- •25. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Понятие об активных частицах и энергии активации. Уравнение Аррениуса.
- •27. Катализаторы химических реакций. Представление о механизме катализа. Специфичность катализа. Примеры и роль каталитических процессов при химической переработке древесного сырья.
- •28. Растворы. Процессы при образовании растворов. Идеальные и реальные растворы. Гидраты и сольваты.
- •29. Концентрации раствора и способы её выражений (массовые доля и процент, молярная доля, молярность, нормальность, молярность). Плотность раствора.
- •30. Растворимость газов, жидкостей и твёрдых веществ в жидкостях. Закон Генри. Ненасыщенные, насыщенные и пересыщенные растворы.
- •31. Растворы неэлектролитов. Понятие об осмосе и осмотическом давлении. Закон Вант-Гоффа. Изотонические растворы. Роль осмоса в жизни растений.
- •32. Давление насыщенного пара растворителя над раствором нелетучего растворенного вещества. Закон Рауля. Температуры замерзания и кипения растворов (влияние концентрации).
- •33. Растворы электролитов. Сильные и слабые электролиты. Связь кажущейся степени диссоциации с изотоническим коэффициентом. Понятие об активности и ионной силе раствора.
- •34. Обменные реакции между ионами. Молекулярные и ионные уравнения реакций. Условия необратимости ионных реакций.
- •35. Степень и константа диссоциации слабого электролита. Закон разбавления Оствальда. Ступенчатая диссоциация электролита. Влияние общих ионов на диссоциацию слабых электролитов.
- •37. Растворимость малорастворимых твердых электролитов в воде. Произведение растворимости (пр). Влияние общих ионов на растворимость. Амфотерные гидроксиды и оксиды.
- •38. Гидролиз солей по катиону, аниону, катиону и аниону. Ступенчатый гидролиз. Необратимый совместный гидролиз солей. Уравнения реакций.
- •39. Степень и константа гидролиза солей. Подавление и усиление гидролиза. Изменение водородного показателя при гидролизе. Применение гидролизующих солей при химической переработке древесины.
- •40. Протолиты и протолитические равновесия. Сродство к протону. H-кислоты и основания. Влияние природы растворителя на кислотно-основные свойства веществ
5. Химический эквивалент элемента, оксида, гидроксида и соли. Молярная масса эквивалента, молярный объём эквивалента газа. Общая и частные формулы закона эквивалентов.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества
Эсоли=1/|Zkat||Zan|
Эгидроксид=1/n(ОН)
Эоксида=1/|ст.ок.||кол. ат. элемента|
Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
|
МЭ = МfЭ. |
эквивалентный объем газа, представляет собой отношение объема порции данного газа к эквивалентному количеству вещества в этой порции
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8
МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка)
МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Для любых двух веществ, связанных законом эквивалентов, можно записать:
|
|
6.Строение атома. Ядро и электроны, протоны и нейтроны, их заряд и масса. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Представление об атомных спектрах.
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства. Заряд ядра равен Ze, где e – заряд протона, Z– зарядовое число, равное порядковому номеру химического элемента Масса ядра измеряется в атомных единицах массы (а.е.м). За одну атомную единицу массы принимается 1/12 часть массы нейтрального атома углерода 12 С
Электрон
имеет двойственную (корпускулярно-волновую)
природу. Благодаря волновым свойствам
электроны в атоме могут иметь только
строго определенные значения энергии,
которые зависят от расстояния до ядра.
Электроны, обладающие близкими значениями
энергии образуют энергетический уровень.
Он содержит строго определенное число
электронов - максимально 2n2.
Энергетические уровни подразделяются
на s-, p-, d-
и f-
подуровни; их число равно номеру уровня.
![]() кг[1] —
масса электрона.
кг[1] —
масса электрона.
![]() Кл[1] —
заряд электрона.
Нейтрон — элементарная
частица,
не имеющая электрического
заряда.
Нейтрон является фермионом и
принадлежит к классу барионов. Атомные
ядра состоят
из нейтронов и протонов.
Нейтрон
(n)
– нейтральная частица с массой покоя mn =
1,675·10–27кг
= 1839me ,
нулевой заряд.
Кл[1] —
заряд электрона.
Нейтрон — элементарная
частица,
не имеющая электрического
заряда.
Нейтрон является фермионом и
принадлежит к классу барионов. Атомные
ядра состоят
из нейтронов и протонов.
Нейтрон
(n)
– нейтральная частица с массой покоя mn =
1,675·10–27кг
= 1839me ,
нулевой заряд.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу). Протон имеет положительный заряд е+=1,06·10–19 Кл и массу покоя mp = 1,673·10–27кг = 1836me
Квантовый характер излучения и поглощения энергии электромагнитного поля был постулирован М. Планком в 1900 году для объяснения свойств теплового излучения
уравнение Планка: E=hv (h-постоянная планка =6,62 на 10 в минус 34
АТОМНЫЕ СПЕКТРЫ - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.

 или
или 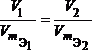 или
или  ,
,