
Начала термодинамики.
Начала термодинамики— совокупностьпостулатов, лежащих в основетермодинамики. Эти положения были установлены в результате научных исследований и были доказаны экспериментально. В качестве постулатов они принимаются для того, чтобы термодинамику можно было построить аксиоматически.
Необходимость начал термодинамики связана с тем, что термодинамика описывает макроскопические параметры систем без конкретных предположений относительно их микроскопического устройства. Вопросами внутреннего устройства занимается статистическая физика.
Начала термодинамики независимы, то есть ни одно из них не может быть выведено из других начал.
Перечень начал термодинамики
Первое начало термодинамикипредставляет собой закон сохранения энергии в применении к термодинамическим системам.
Второе начало термодинамикинакладывает ограничения на направление термодинамических процессов, запрещая самопроизвольную передачу тепла от менее нагретых тел к более нагретым. Также формулируется какзакон возрастания энтропии.
Третье начало термодинамикиговорит о том, какэнтропияведет себя вблизи абсолютного нуля температур.
Нулевым (или общим) началом термодинамикииногда называют принцип, согласно которому замкнутая система независимо от начального состояния в конце концов приходит к состояниютермодинамического равновесияи самостоятельно выйти из него не может.
Работа расширения газа и внутренняя энергия.
При расширении идеального газа совершается работа, которая вычисляется по уравнению:
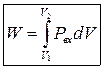 w– работа, р – давление,d(дельта)V– изменение объема
w– работа, р – давление,d(дельта)V– изменение объема
В дифференциальной форме:
![]()
Это максимальная работа, которую совершает газ в обратимых процессах (в равновесных условиях). В необратимых процессах работа меньше, чем ее значение, вычисленное по формуле .
Теплоемкость.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяемая отношением бесконечно малого количества теплоты δ(дельта)Q, полученного телом, к соответствующему приращению его температуры δT[1]:
![]()
Единица измерения теплоёмкости в Международной системе единиц (СИ) — Дж/
Теплоемкость вещества — теплоемкость единицы массы данного вещества. Единицы измерения — Дж/(кг К) . Молярная теплоемкость — теплоемкость 1 моля данного вещества. Единицы измерения — Дж/(моль К) . Если же говорить про теплоемкость произвольной системы, то ее уместно формулировать в терминах термодинамических потенциалов — теплоемкость есть производная термодинамического потенциала Q по температуре: Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов) , так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоемкости электронного газа) . Если речь идёт не о каком-либо теле, а о некотором веществе как таковом, то различают удельную теплоёмкость — теплоёмкость единицы массы этого вещества и молярную — теплоёмкость одного моля его.
Процессы в идеальном газе. Изохорический процесс.
Изохорический или изохорный процесс—термодинамический процесс, который происходит при постоянномобъёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
При изохорическом процессе давлениеидеального газапрямо пропорционально еготемпературе(см.Закон Шарля). В реальных газах закон Шарля не выполняется.
Термодинамика процесса
Из определения работы следует, что изменение работы при изохорном процессе равно:
![]()
Чтобы определить полную работу процесса проинтегрируем данное выражение. Поскольку объем неизменен, то:
![]() ,
,
Но такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает:
![]() .
.
Графически доказать это намного проще. С математической точки зрения, работа процесса — это площадь под графиком. Но график изохорного процесса является перпендикуляром к оси абсцисс. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле:
![]() ,
,
где i — число степеней свободы, которое зависит от количества атомов в молекуле (3 для одноатомной (например, неон), 5 для двухатомной (например, кислород) и 6 для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде:
![]() ,
,
где
![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Используя первое начало термодинамики можно найти количество теплоты при изохорном процессе:
![]()
Но при изохорном процессе газ не выполняет работу. То есть, имеет место равенство:
![]() ,
,
то есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.
