
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
2. Схемы и механизм сульфирования аренов
Сульфирование аренов может быть представлено следующими химическими схемами (в зависимости от используемого сульфирующего агента):
![]()
![]()
Сульфирование ароматических соединений является реакцией электрофильного замещения(SE) и обычно протекает по схеме:

Отличием этой реакции от других реакций SEявляется ееобратимость,которая в наибольшей степени проявляется лишьв концентрированной серной кислоте. Выделяющаяся реакционная вода способствует диссоциации серной и сульфоновой кислот с образованием протона (электрофила), что приводит к десульфированию. В случаеолеума и сульфотриоксидаконцентрация протона крайне низка и реакция сульфирования практически необратима.
Скорость и направлениереакции в большой степени определяется строением субстрата, т. е. устойчивостью-комплекса (кинетический фактор), однако при сульфированиисерной кислотойнаправление реакции может зависеть и от устойчивости продуктов реакции (термодинамический фактор)
Электронодонорные (Д)заместители в арене облегчают прохождение реакции, аэлектроноакцепторные (А) — затрудняют.

Сульфирующими частицамиявляются поляризованные молекулы и катионы Н3SO4+ <SO3,S2O6,S3O9 < НSO3+(в порядке возрастания активности), которые имеются в серном ангидриде или образуются в олеуме и при диссоциации кислоты:

Молекулы органического соединения могут одновременно взаимодействовать с различными сульфирующими частицами, т.е. реакция может протекатьпо нескольким схемам.
Сама H2SO4 не является электрофилом и не способна сульфировать органические соединения. Если при сульфировании арена концентрированной серной кислотой в реакционную массу добавить сульфат натрия, скорость сульфирования резко падает и при определенной концентрации соли процесс останавливается. Считается, что соль подавляет диссоциациюH2SO4, и сульфирующие частицы не образуются.

Тепловой эффект сульфирования ареновсерной кислотой, рассчитанный по закону Гесса, относительно невелик (73 кДж/моль), так как он является суммой экзотермического процесса взаимодействияSO3с субстратом и эндотермического — диссоциацииH2SO4с образованиемSO3. В реальном процессе он в1,5—2 раза выше рассчитанного, за счет теплоты, выделяющейся при разбавлении серной кислоты реакционной водой. Тепловой эффект сульфированиясерным ангидридом (олеумом) высок и составляет около200 кДж/моль (нет затрат на образованиеSO3).
3. Особенности сульфирования аренов серной кислотой
Сульфирование серной кислотой начинается обычно как гетерогенный процесс. Однако затем реакционная масса гомогенизируется, и основное время процесс протекает какгомогенный. Особенности его, в основном,связаны с влиянием концентрации и растворяющей способности серной кислоты, температуры и времени реакции на скорость и направление сульфирования и массу сульфирующего реагента, необходимую для осуществления реакции.
Концентрированная серная кислота диссоциирует по двум направлениям:
![]()
Чем больше ее концентрация(меньше воды), тем в большей степени равновесие смещается влево, больше образуется электрофильных частиц итем быстрее идет реакция.
По мере прохождения сульфирования вода, образующаяся в процессе реакции, снижает концентрацию кислоты:
![]()
Это затрудняет собственную ионизацию H2SO4 и способствует ее кислотной диссоциации (равновесие смещается вправо). Концентрация сульфирующих частиц (H3SO4+,SO3,HSO3+), которая даже в 100 %-нойH2SO4составляет доли процента, уменьшается, искорость сульфирования резко снижается.
Минимальную концентрациюсерной кислоты (выраженную в %SO3), при которой она еще способна сульфировать соединение, называют«-сульфирования» (с).
За величину «-сульфирования» принимают концентрацию серной кислоты, при которой скорость образования продукта составляет менее 1 % за час.
На практике процесс ведут так, чтобы в конце сульфирования концентрация оставшейся серной кислоты была выше с, так как, в противном случае, скорость реакции будет слишком мала.
Эта величина полезна также при определении массы реагента.
Минимальное количество серной кислоты или олеума, необходимое для моносульфирования 1 моль соединения, может быть вычислено по формуле:
![]()
где С — начальная концентрация сульфирующего агента в %SO3.
Чем выше концентрация исходной кислоты, тем меньше ее понадобится для проведения процесса. Однако следует иметь в виду, что повышение концентрации сульфирующего агента может привести к нежелательным побочным эффектам (образование полисульфокислот, сульфонов, окисление субстрата и т.д.).
При сульфировании нафталина концентрация серной кислоты может определять направление реакции, при этом из нафталина могут быть целенаправленно получены α- и β-нафталинсульфокислоты:
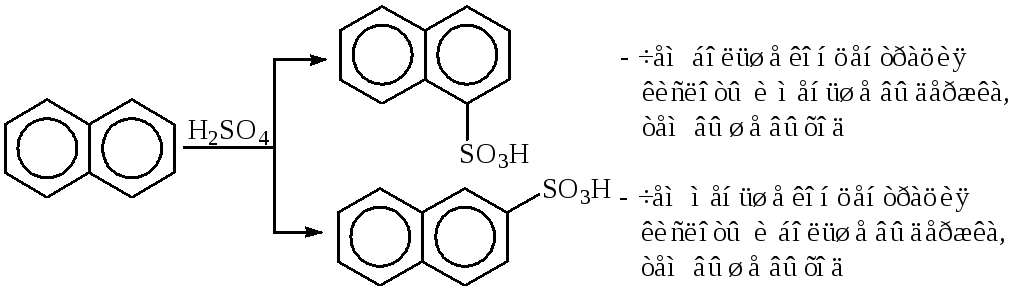
Для получения α-нафталинсульфокислоты рационально применять более концентрированную кислоту, чтобы предотвратить десульфирование продукта реакции. При получении β-нафталинсульфокислоты следует брать серную кислоту несколько меньшей концентрации, чтобы способствовать гидролизу побочного α-изомера (β-изомер в этих условиях не десульфируется).
Известно, что повышение температуры увеличивает скорость реакции. Так, для бензола и его гомологов повышение температуры на каждые 10 °С увеличивает скорость сульфирования в 1,5—2 раза (что определяется энергией активации, которая колеблется в довольно широких пределах).
Однако, повышая температуру с целью увеличения скорости реакции, необходимо помнить, что ее изменение сказывается и на структуре образующихся продуктов. Так, при сульфировании фенола серной кислотой при комнатной температуре образуется преимущественноорто-изомер, а при 100 °С —пара-изомер.

![]()

При обработке фенола, взятого в избытке, купоросным маслом при 160—180 °С получают 4,4'-дигидроксидифенилсульфон, образование которого объясняют электрофильной атакой ArSO2+исходного субстрата. Наконец, при избытке сульфирующего агента возможно полисульфирование.
В связи с этим в зависимости от активности субстрата и желательного направления реакции процесс сульфирования ведут в одних случаях с нагревом, а в других — сохлаждениемреакционной массы, при этом температура реакции можетколебаться от –10 °С до 180 °С.
Продолжительность ведения процесса при одинаковых условиях также влияет на максимальный выход целевого продукта, поскольку процесс сульфирования описывается рядом параллельных и последовательных реакций (пример сульфирования нафталина).
Основные недостатки сульфирования серной кислотой:
1) малая концентрация электрофильных частиц;
2) быстрое снижение скорости реакции в процессе сульфирования (вследствие разбавления кислоты реакционной водой);
3) отсутствие возможности сульфирования малоактивных субстратов;
4) окислительные и агрессивные свойства реакционной среды;
5) технологические и экологические трудности на стадии выделения продукта (избыток сульфирующего агента приводит к необходимости использования больших количеств нейтрализующих средств, технологическому усложнению этой стадии и образованию большого количества отходов производства).
Некоторые из этих недостатков можно устранить удалением образующейся воды из реакционной массы. Ниже приведены наиболее широко применяемые в промышленности модификации метода.
«Сульфирование в парах» предполагает азеотропную отгонку воды из реакционной массы, либо с избыткомлетучего субстрата (бензолом, толуолом и др.), либо (в случаевысококипящихуглеводородов) со специально введенным в реакционную массу инертным азеотропным агентом (хлороформом, лигроином и др.).
При сульфировании бензола «в парах» расход серной кислоты снижается в 1,8 раза по сравнению с обычным сульфированием. Однако при этомснижается скорость сульфирования (вследствие уменьшения концентрацииH2SO4в реакционной массе) и процесс идет приболее высокой температуре, необходимой для эффективного удаления воды.

Рис. 1. Аппаратурные схемы непрерывного и периодического сульфирования бензола «в парах»
1 — реактор, 2 — сепаратор, 3 — холодильник, 4 — испаритель
«Сульфирование запеканием» применяют для сульфирования ароматических аминов. Сначала из амина и разбавленной серной кислоты получают соль, которую выделяют и нагревают до 180—190 °С («запекают»). При этом образуетсяо- илип-аминосульфокислоты. Раньше «запекание» соли осуществляли в специальных печах. В настоящее время этот процесс проводят в среде полихлорбензолов:

При нагревании сульфата амина с полихлоридами бензола первоначально отгоняют азеотропную смесь воды с растворителем. Пары конденсируют, воду отделяют в отстойнике, а растворитель возвращают в реактор. Затем реакционную массу нагревают до 180 °С и выдерживают при кипении полихлорбензолов. По окончании процесса растворитель отгоняют, добавляют раствор NaOHи отгоняют с острым паром остатки полихлоридов и ароматического амина. Соль продукта остается в аппарате.
Таким образом, получают сульфаниловую (1) и нафтионовую кислоты (2), 4-амино-2,5-дихлор- (3) и 4-диметиламинобензолсульфокислоту (4).

Основными недостатками метода являются его ограниченность (применяется только для сульфирования ароматических аминов), энергоемкость и многостадийность.
