
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
1. Синтез алкенов методами каталитического и окислительного дегидрирования
Для синтеза алкенов из алканов используют каталитическое и окислительное дегидрирование. В результате этих процессов повышается степени окисления атомов в органических соединениях.
Примером каталитического дегидрирования может служить «ароматизация» 3,4-дигидропапаверина в присутствии палладия на сульфате бария в среде тетралина при190—200 °Св синтезепапаверина и 4,5-дигидроимидазола на никелевом катализаторе при нагревании при полученииметронидазола:


Окислительное дегидрированиечаще всего проводятхлоранилом(2,3,5,6-тетрахлор-1,4-бензохинон) иДДХ(2,3-дихлор-5,6-дициано-1,4-бензохинон), и в значительно более мягких условиях (при температуре около 100 °С) с выходом более 80 %:

Выход образующегося продукта зависит от использованного хинона, природы растворителя и кислотности среды.


Окислительное дегидрирование диоксидом селена менее селективно, но также применяется в химии стероидов, например, в синтезе ципротеронацетата:
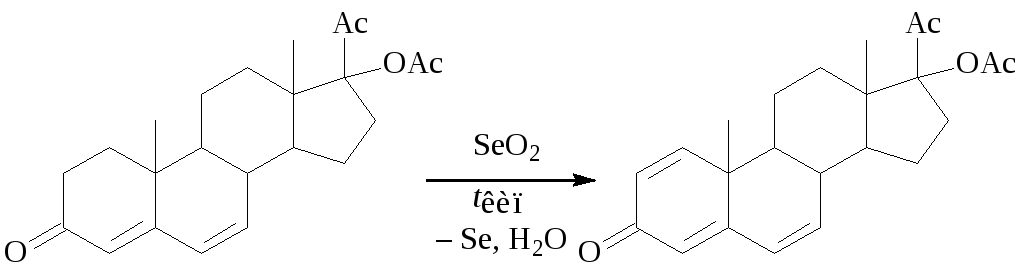
2. Синтез альдегидов с использованием методов окисления и дегидрирования
Альдегиды являются химически активным классом органических соединений и широко используются в синтезах лекарственных веществ в качестве исходных веществ и полупродуктов. Однако при синтезе их окислительными методами возникают трудности, связанные с тем, что они, как правило, окисляются легче, чем субстрат, а также способны к реакциям полимеризации и конденсации. В связи с этим альдегиды лучше всего получать каталитическим дегидрированием спиртов.
Каталитическое дегидрирование спиртов ведут в присутствии катализаторов на основе меди и серебра. Процесс идет с хорошим выходом (около 90 %), но при температурах более 200 °С.

Окисление органических соединений в альдегиды возможно лишь при использовании селективных окислителей и катализаторов и специальных технологических приемов.
Применение высокоселективных окислителейв синтезе альдегидов:
Оксид селена (IV) окисляет активированные метильные и метиленовые группы, находящихся рядом с карбонилом и ароматическим ядром. Таким способом могут быть получены алифатические, ароматические и гетероциклические альдегиды:
![]()

![]()
Жидкие вещества окисляют без растворителя, для твердых в качестве растворителя используют спирт, этилацетат, ксилол, диоксан. Выходы составляют 50—90 %.
Комплексы оксида хрома (VI) и ДМСО в присутствии галогеноводорода и кислорода воздуха окисляют первичные спирты:

Считают, что в присутствии ДМСО и галогеноводородной кислоты (НХ) кислород окисляет не спирт, а образовавшийся диметилсульфид:

Периодат натрия окисляет α-гликоли с разрывом углерод- углеродной связи при пониженных температурах 0—20 °C с количественным выходом:

Уротропин (гексаметилентетрамин) окисляет бензиламины или бензилгалогениды (реакция Соммле):
![]()
В этом синтезе в альдегид окисляется алифатический амин, который в связи с повышенной электронной плотностью на атоме азота легко окисляется до имина даже таким окислителем, как уротропин. Считают, что реакция Соммле с галогенидами протекает через стадию образования четвертичной аммониевой соли с гексаметилентетрамином. При нагревании такой четвертичной аммонийной соли в слабокислой среде образуется азометин, гидролизующийся до амина. Амин окисляется уротропином до имина, который гидролизуется до альдегида:
![]()
![]()
Электроноакцепторные заместители в ароматическом ядре замедляют реакцию (SN1). Ароматические альдегиды по этому методу образуются с выходом 50—80 %. В алифатическом ряду реакция не применяется вследствие малого выхода целевых продуктов (вероятно, в связи с меньшей активности алкилгалогенидов по сравнению с бензильными):

Из бисхлорметильных соединений образуются п-им-диальдегиды.о-Диальдегиды не образуются.

Неселективное окисление толуола и его производныхвоздухом в жидкой и газовой фазах приводит к образованию смеси продуктов. В жидкой фазе основным продуктом является бензойная кислота и ее производные. Бензальдегид образуется при этом в относительно небольших количествах.
Применение высокоселективных катализаторов (оксиды урана, молибдена и меди) при окислении толуола повышает выход бензальдегида до 85—90 %. Реакцию ведут в газофазной среде пропусканием смеси паров толуола и воздуха над катализатором при температуре 475—500 °С:

При использовании обычных окислителей необходимо применять специальные технологические приемы:
Превращение образующегося альдегида в более стабильное производное (например, диацетат при окислении субстрата в присутствии уксусного ангидрида), которое в дальнейшем можно количественно превратить в альдегид (например, гидролизовать).

Отгонка низкокипящего альдегида из реакционной массы.
![]()
Извлечение образовавшегося альдегида в инертную фазу без окислителя (например, окисление MnO2в эфире или дихроматом натрия в толуоле). Таким методом можно получить анисовый альдегид, который используется в синтезах некоторых лекарственных веществ, например, гипотензивного средствакардизема:
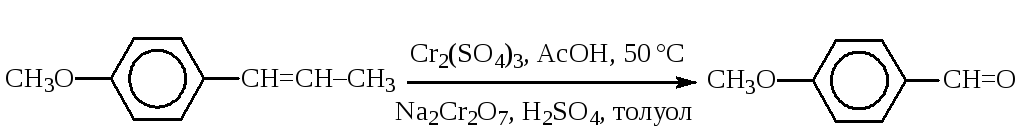
Использование особенностей субстрата, окислителя и условий реакций, например:
а) окислениебензилхлорида и его замещенных производных бихроматом в щелочной среде:
![]()
В данном случае галогенид окисляется в таких условиях, при которых альдегид сохраняется.
б) При окислении толуола и его производных двуокисью марганца в серной кислоте альдегид сохраняется за счет пониженной активности окислителя и строго определенного температурного режима.
![]()
Кислотность среды зависит от количества окислителя. В тех случаях, когда двуокись марганца берут в избытке, используют водную серную кислоту. Если двуокись марганца взята в стехиометрическом соотношении, применяют избыток концентрированной серной кислоты.
Окислитель малоселективный, но низкая скорость реакции при температуре менее 40 °С позволяет получать альдегид, однако уже при 60—70 °С основным продуктом является бензойная кислота.
