
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
Восстановление гидридами металлов
Гидриды металлов, особенно алюмогидрид лития (LiAlH4) и боргидрид литияLiBH4или натрияNaBH4, обладают сильными восстановительными свойствами и используются для восстановления полярных соединений, имеющих двойные связи углерод–гетероатом.
Эти связи поляризованы и имеют частичный положительный заряд на атоме углерода, поэтому им характерны реакции присоединения С-, N- и О-нуклеофилов, которые в ряде случаев завершаются отщеплением уходящей группы. Рассматриваемые нами гидриды металлов могут играть роль Н-нуклеофила, как, например, металлоорганические соединения — С-нуклеофила, и отдавать гидрид-ион атому углерода, имеющему дефицит электронов.
Ниже приведен химизм реакции гидрида металла с карбонильной группой, которая идет особенно легко при восстановлении алюмогидридом лития альдегидов и кетонов до алкоголятов:
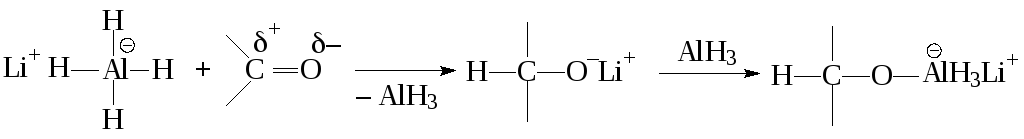
Перенос гидрид-иона осуществляется как синхронное расщепление связи металл–водород и образование С–Н-связи.
Последовательно в реакцию вступают все остальные атомы водорода гидрида, затем образовавшийся комплексный алкоголят лития и алюминия подвергается гидролитическому расщеплению:

Если в молекуле субстрата имеются «активные» водородные атомы, то алюмогидрид лития реагирует с ними в первую очередь, образуя водород.
Восстановление комплексными гидридами имеет важные преимущества по сравнению с другими методами: оно протекает, как правило, в очень мягких условиях и с высокими выходами. Этот метод особенно хорош при работе с ценными препаратами и с малыми количествами. Кроме того, он позволяет гладко восстанавливать малоактивные производные кислот.
Используя различные комплексные гидриды и растворители можно добиться высокой селективности восстановления.
Алюмогидрид лития — комплексное солеобразное соединение с формулойLi+AlH4–. Это белый мелкокристаллический очень гигроскопичный порошок. При контакте с водой он разлагается с выделением водорода. Алюмогидрид лития медленно растворяется в эфирах с образованием новых комплексов —эфиратов.
Алюмогидрид лития восстанавливает карбонильные соединения,карбоновые кислоты и все их кислород и галогенсодержащиепроизводные до спиртов, азотсодержащие производные и алифатическиенитросоединения — до аминов, а такжегалогенидыиспирты — до углеводородов:


По легкости восстановления субстраты можно расположить в следующем порядке: альдегиды > кетоны > сложные эфиры > ангидриды кислот > кислоты > нитрилы > амиды > нитрогруппы. В литературе имеются и несколько другие данные о реакционной способности соединений.
Алюмогидрид лития восстанавливает практически все связи углерод–гетероатом, но не двойные связи углерод–углерод. Такая селективность позволяет восстановить функциональные группы в ненасыщенных углеводородах.
Добавление к алюмогидриду лития эквимолярного количества хлорида алюминия значительно увеличиваетего восстанавливающее действие, что, по-видимому, связано с образованием гидрида алюминия и хлорида лития.
Восстановление алюмогидридом лития протекает в безводной среде, как правило,в эфире. Вместо диэтилового эфира в качестве растворителей можно использовать тетрагидрофуран, дибутиловый эфир, морфолин и др. Применение этих растворителей позволяет проводить восстановление при более высокой температуре, чем в диэтиловом эфире. Для увеличения растворимости субстрата эфиры иногда смешивают с бензолом или толуолом.
Работа с алюмогидридом лития требует особых мер предосторожности. Важно избегать контакта алюмогидрида лития с водой, так как это вызывает бурное разложение восстановителя с выделением воспламеняющегося в присутствии воздуха водорода. Тщательноеобезвоживаниерастворителей является обязательным условием для работы с алюмогидридом лития.
В связи с тем, что с алюмогидридом лития можно работать только в безводной среде, в инертных органических растворителях, он непригоден для восстановления соединений, не растворяющихся в них, например, сахаров. В таких случаях хорошие результаты дает боргидрид натрия, который разлагается водой очень медленно.
В химико-фармацевтической промышленности алюмогидрид лития применяют:
а) для восстановления этилового эфира себациновой кислоты с лучшим выходом, чем в других методах (в синтезе противогрибкового препарата декамин)

б) в синтезе октадина

В синтезе нобриумаалюмогидридом лития восстанавливают амид до вторичного амина (а), анальгетикадиклофенака— карбоксильную группу до спирта (б), а:


Боргидрид натрия является менее активным реагентом, чем алюмогидрид лития. Он обычновосстанавливаеттолькохлорангидридыкислот,карбонильныесоединения иоснования Шиффа, но восстанавливает в таких полярныхрастворителях, как вода, метанол, пиридин, ацетонитрил.

Боргидрид натрия широко использует для избирательного восстановленияальдегидов и кетонов в присутствии других функциональных групп:

При этом восстановление боргидридом натрия не затрагивает галоген, сложноэфирные группы, сульфамидные и др.
