
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
Глава 8. Методы восстановления
Восстановлением называют процесс, в результате которого атом или группа атомов приобретают электроны. Наоборот,окисление заключается в потере электронов.
Более точно, речь идет об изменении плотности электронного облака, которое окружает рассматриваемую группировку атомов (субстрата). При восстановлении оноувеличивается, а при окисленииуменьшается.
Восстановление и окисление являются неразрывно связанными процессами. Если одно из участвующих в реакции веществ восстанавливается, то другое окисляется. Поэтому отнесение одних реакций к процессам окисления, а других — к процессам восстановления определяется тем, какое вещество является в данном случае субстратом.
Примером может служить реакция между ионом иода и молекулой хлора. Если субстратом является иодид калия, то это процесс окисления, если молекула хлора, то — восстановления:
![]()
Для сравнения начального и конечного состояния веществ в окислительно-восстановительных реакциях используется такое формальное понятие как степень окисления. Существуют разные способы определения ее. Наиболее простым является «школьное»: степень окисления — это тот условный заряд атома, который возникает на нем при условии, что электронные пары связей полностью сместятся к более электроотрицательному атому, образующему эту связь, а электроны связи между одинаковыми атомами будут поделены пополам.
В окислительно-восстановительных процессах наряду с перераспределением электронного облака молекулы, обычно изменяетсяи еесостав. Например, при восстановлении двойной связи молекулаприобретает два атома водорода:

а при восстановлении спиртов или нитросоединений молекула теряет атомы кислорода:

Многочисленные методы восстановления и окисления можно разделить на четыре группы:химические, каталитические, электролитические и биохимические (микробиологические). Все эти методы находят широкое применение в фармацевтической промышленности
1. Химические методы восстановления
Химические методы восстановления многочисленны и разнообразны. Их можно разделить на две большие группы по типу реагента: восстановление металлами и солями металлов и восстановление соединениями серы.
Восстановление металлами и солями металлов
Эта наиболее многочисленная группа включает восстановление органических соединений с использованием таких металлов и их солей, как натрий, олово, цинк, железо и некоторых других.
Восстановление натрием
Известны три метода применения натрия в этих целях: восстановление натрием в спирте, в жидком аммиаке и амальгамой натрия.
Восстановление натрием в спирте (по Буво-Блану)используется для восстановлениясложных эфиров (или хлорангидридов) карбоновых кислот, реже кетонов до соответствующих спиртов инитрилов— до аминов. Наибольшее значение метод имеет в синтезе высших алифатических спиртов, получить которые другим путем трудно. У многоосновных кислот восстанавливаются только этерифицированные карбоксильные группы.
Суммарное уравнение реакции восстановления сложных эфиров имеет вид:
![]()
Механизм процесса можно представить следующим образом:

Натриевая соль полуацеталя альдегида отщепляет алкоголят-ион и образовавшийся альдегид восстанавливается аналогично сложному эфиру до алкоголята первичного спирта.

Выход целевых продуктов, как правило, не превышает 80 %. Потери обусловлены непосредственной реакцией между натрием и спиртом. Выделяющийся водород неактивен, а образующиеся алкоголяты вызывают конденсацию, переэтерификацию и образование высококипящих побочных продуктов.
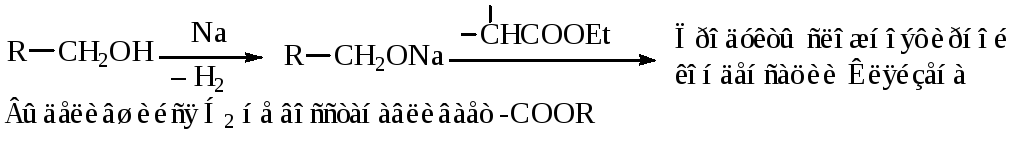
В связи с этим для проведения реакции Буво-Блана наиболее пригодны вторичные спирты, которые являются более слабыми кислотами, чем первичные спирты, и менее активно реагируют с натрием. Например, в промышленности применяют метилциклогексанолы, получаемые восстановлением смеси трех крезолов, а в лаборатории также 2-пропанол и циклогексанол.
Методика восстановления по Буво-Блану простая, но опасная.
К кипящей смеси сложного эфира и пятикратного количества абсолютного спирта порциями добавляют кусочки металлического натрия, взятого в небольшом избытке. После загрузки всего натрия и необходимой выдержки, реакционную массу выливают в воду для разложения образовавшихся алкоголятов. (В ряде случаев перед смешением с водой к реакционной массе добавляют метанол для растворения остатков натрия). Спирт отгоняют, а продукты реакции извлекают экстракцией.
Отвод тепла является сложной технической проблемой, т.к. тепловой эффект реакции очень высок (520 кДж/моль). Необходимо обязательно использовать хорошо действующий (эффективный) обратный холодильник. Чтобы облегчить задачу охлаждения реакционной массы и снизить опасность процесса, можно поднять температуру процесса заменой этилового спиртавысококипящими спиртами (амиловым, циклогексанолом и др.) Так, восстановление этилового эфира себациновой кислоты проводят в 1-бутаноле (синтез препаратадекамина).

Диэтиловый эфир себациновой кислоты растворяют в безводном бутиловом спирте, затем при 70 °С и энергичном перемешивании в несколько приемов добавляют натрий. Температуру поднимают до 100—125 °С. Выход продукта 72 %.
Для снижения опасности процесса в ряде случаев изменяют порядок загрузки реагентов. Так, при восстановлении этилового эфира 3,3-дифенилпропановой кислоты в производстведифрила спиртовой раствор эфира прибавляют к натрию («обратная загрузка»):
![]()
Это позволяет полностью использовать металлический натрий, который при стандартном способе может частично не прореагировать и остаться в реакционной массе, что создает опасность при разбавлении реакционной массы водой.
Щелочные металлы (калий, натрий, литий) в жидком аммиаке обычноприменяют для восстановления:
а) сложных эфиров (режекетонов) до спиртов (лучше, чем по методу Буво-Блана);
б) ацетиленовых углеводородов до олефинов (при этом тройная связь на конце цепи не восстанавливается)
![]()
![]()
в) органических галогенидов до углеводородов или аминов
![]()
![]()
Механизм аналогичен механизму восстановления по Буво-Блану.
Щелочные металлы (калий, натрий и литий) хорошо растворяются в аммиаке и позволяют работать в широком интервале концентраций. Низкая степень диссоциации аммиака делает возможным восстановление соединений, которые гидролизуются в воде. Аммиак с натрием может образовывать амид, но в отсутствие катализаторов и при наличии соединений, способных восстанавливаться, эта реакция практического значения не имеет.
Для ведения процесса необходима специальная аппаратура, т.к. температура кипения аммиака очень низка (–33,5 °С). При более высокой температуре реакцию проводят в автоклаве. Для достижения гомогенности смеси необходимо энергичное перемешивание.
Восстановление амальгамой натрия. Амальгаму натрия получают растворением натрия в ртути. Однако это не только раствор натрия. Ртуть со щелочными и щелочноземельными металлами образуетмеркуриды МеHgx(например,NaHg2,KHg2,MgHg).
Амальгама, содержащая меньше 1,25 % натрия, при комнатной температурежидкая. При более высокой концентрации натрия амальгама при комнатной температуре становитсятвердойи ее можно измельчать механически.
При получении амальгамы используют очищенные реагенты и исключают контакт их с железом, следы которого при использовании амальгамы катализируют побочные реакции. Процесс растворения натрия в ртути (обычно к измельченному натрию добавляют ртуть) идет с выделением тепла, поэтому, чтобы предохранить теплую амальгаму от воздействия кислорода воздуха, его ведут под слоем толуола или в атмосфере азота. Отвод тепла реакции вызывает определенные трудности, т.к. использование воды в качестве хладагента исключено. Обычно температура реакции около 40—50 °С, при этом получают2—3 %-ую амальгаму. Наиболее чистуюжидкую и однородную амальгаму, содержащую до 0,5 % натрия, получаютэлектролитическим методом.
В синтезе лекарственных веществ амальгамой натрия восстанавливают:
а) сопряженные двойные связи (но не изолированные)
![]()
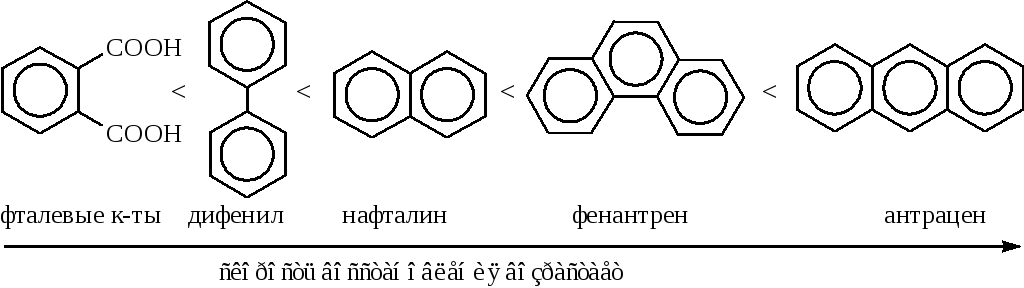
б) отдельные представители аренов, например, фталевые кислоты, ароматические полициклические углеводороды (до ди- или тетрагидропроизводных).
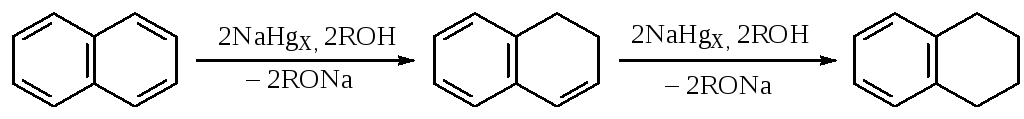
Необходимо отметить, что способность этих соединений восстанавливаться амальгамой натрия увеличивается от производных бензола к антрацену:
в) карбонильную группу в альдегидах и кетонах до соответствующих спиртов (очень легко!).
![]()
Например, в синтезе отечественного препарата кватерона3-метил-4-диэтиламино-2-бутанон восстанавливают в соответствующий спирт амальгамой натрия в уксусной кислоте:

г) нитро- и другие азотсодержащие группы (очень легко), но практического значения этот метод не получил вследствие наличия более доступных восстановителей.
Механизм аналогичен механизмам восстановления по Буво-Блану и натрием в жидком аммиаке.
В адсорбционном слое на поверхности металла к молекуле субстрата присоединяются один или два электрона. Затем образующиеся анионные радикалы или двухзарядные анионы соединяются с протонами:


Методика восстановления: субстрат растворяют или суспендируют вспирте или воде,т.к. амальгама натрия реагирует с водой медленно. Для лучшего растворения субстрата и ускорения реакции в некоторых случаях применяюторганические растворители, смешивающиеся с водой и спиртом, илиэмульгирующиесредства. К смеси при энергичном перемешивании постепенно добавляют избыток амальгамы (25—40 % от теоретического), если процесс идет медленно, реакционную массу можно нагревать. После полного разложения амальгамы, выделившую ртуть отделяют декантацией и промывают водой или спиртом.
Скорость,а иногда и состав продуктов восстановления зависятот величины рН, которая по ходу реакции повышается, при этом скорость реакции замедляется. Точный и непрерывный контроль значения рН осуществляют потенциометрически. Величину рН регулируют пропусканием СО2.
