
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
Условия проведения С-алкилирования аренов по Фриделю-Крафтсу определяются структурой субстрата и типом алкилирующего агента.
Алкилирование аренов алкилгалогенидами используется наиболеешироко и проводится в безводном инертном растворителе (например, нитробензоле) или в избытке субстрата в присутствии кислот Льюиса:
![]()
Активность алкилгалогенидовувеличивается от первичных к третичным. Скорость реакции может отличаться на 4 порядка, однако четкую границу во многих случаях провести нельзя, так как многое определяется катализатором.
Кислота Льюиса определяет, во-первых, строениеи полярностьэлектрофильной частицы, атакующей арен. При ее взаимодействии с алкилгалогенидом образуются поляризованный комплекс, ионная пара или карбокатион:
![]()
В связи с этим, во-вторых,кислота Льюиса, определяетскоростьреакции,составпродуктов реакции и возможностьизомеризацииалкилгалогенида и продукта реакции.
Например, состав продуктов метилирования толуола метилбромидом и метилиодидом в одних и тех же условияхразный, поэтому можно предположить, что реакция протекает с участием разных электрофильных частиц. Если бы частицей был катион СН3+, состав продуктов был быодинаков:
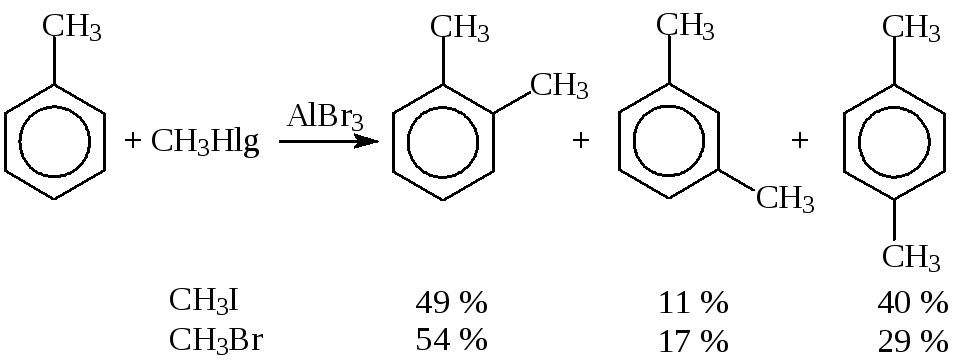
Активный катализатор в большей степени образует карбокатион, который до взаимодействия с ареном успевает изомеризоваться в более устойчивый. В случаемалоактивного катализатораосновной атакующей частицей является поляризованный комплекс, и изомеризация алкила не наблюдается. Например, при алкилировании бензола неопентилхлоридом в присутствииAlCl3образуетсятрет.пентилбензол, а в случаеFeCl3, — неопентилбензол:

Хлористый алюминий практически всегда вызывает изомеризацию углеродной цепи галогеналкилов.
Алкилирование аренов геминальными ди-, три- и тетрагалогенидами идет в тех же условиях, что и с алкилгалогенидами, с образованием ди- и трифенилметана и их производных:

Однако четыре фенильных ядра к одному атому углерода не присоединяются:
![]()
В производстве димедрола из тетрахлорметана и бензола получают дихлордифенилметан:
![]()
В синтезе противогрибкового препарата клотримазолаиспользуюто-хлорбензилидинхлорид илио-хлорбензофенон после превращения в дигалогенид:


Алкилирование аренов алкенами ведут в присутствии протонных или апротонных кислот в безводном инертном растворителе или в избытке субстрата аналогично алкилированию галогенидами.

Образование электрофильных частицпроходит по схеме:

Согласно другой точке зрения кислота Льюиса в присутствии протонсодержащих веществ (следы воды, спирт и др.) сначала превращается в протонную кислоту, которая и катализирует процесс:

Радикалы при двойной связи повышают ее нуклеофильность и скорость взаимодействия с катализатором, поэтому, чем больше радикалов, тем активнее алкеныв реакциях с аренами.
Этим способом получают этилбензол (из бензола и этилена), который затем превращают в стирол и используют в синтезелевомицетинаи ряда других препаратов;изопропилбензол (из бензола и пропилена), который служит сырьем для синтеза фенола и ацетона по кумольному методу.

Алкилированием бензола неразветвленными, содержащими от 10 до 15 атомов углерода алкенами (или алкилхлоридами) в присутствии фтороводорода или хлорида алюминия, с последующим сульфированием образовавшихся продуктов, получают биологически мягкие поверхностно-активные вещества:
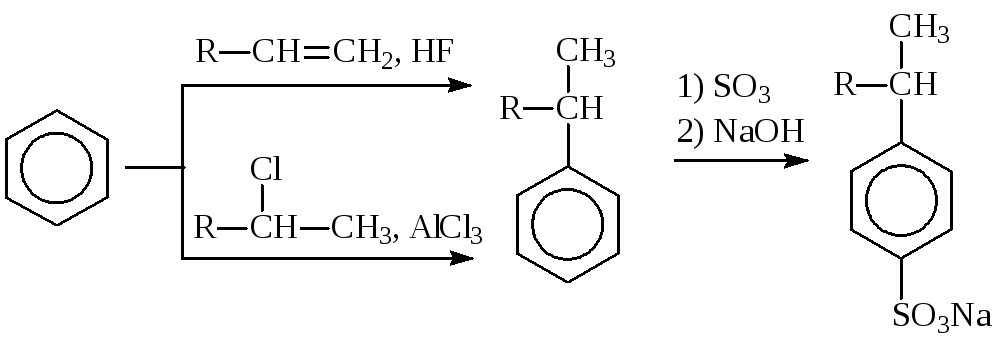
В ряде случаев используют сложные алкилирующие реагенты, как, например, в синтезевитамина Етриметилгидрохинон алкилируют непредельным спиртом изофитолом при 135—140 °С в средео-ксилола с азеотропной отгонкой воды:

Алкилирование аренов спиртами применяют сравнительноредко,и ведут в присутствии сильных протонных кислот (серной и фосфорной), а также хлорида алюминия, алюмосиликата и др. Реакцию проводят какв жидкой, так и в паровой фазе.
![]()
Электрофильные частицы образуются по следующим схемам:
![]()
или

Реакционная способность спиртов в этих реакциях увеличивается от первичных к третичным.
В качестве примеров использования метода, можно привести синтез бутилоксианизола (антиоксидант для пищевой и химфармпромышленности), который ведут в присутствии фосфорной кислоты, и метилирование фенола метанолом в парах в синтезе 2,3,5-триметилфенола, который является сырьем в производствевитамина Е:

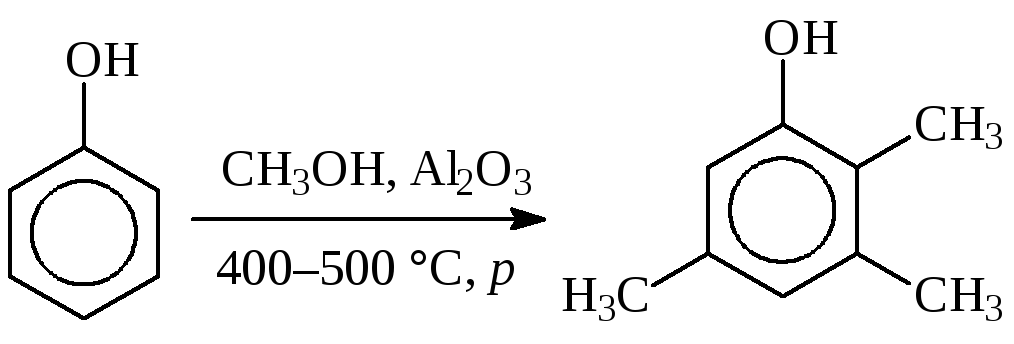
Иногда вместо спиртов используют ихсложные эфиры. Так, в производствехлорбутинаалкилирование бензола проводят-бутиролактоном в присутствии хлорида алюминия:

3. С-Алкилирование алифатических субстратов
Алкилирование алифатических соединений по атому углерода часто встречается в химической промышленности.
На предприятиях основного органического синтеза осуществляют алкилирование алканов алкенами. Реакцию рассматривают какэлектрофильное присоединение алкилкатиона по двойной связи.

Процесс ведут при высокой температуре под давлением (400—500 °С, 30 МПа). Поскольку она обратима и проходит с уменьшением объема, давление способствует более глубокому алкилированию. Процесс может протекать также под влиянием AlCl3,BF3,HClилиH2SO4.
К реакциям С-алкилирования алифатических соединений можно отнести алкилирование алкинов алкилгалогенидами:
![]()
Такие реакции часто встречаются при получении лекарственных субстанций и витаминов, например, в синтезе ненасыщенных алифатических кислот (витаминов группы F):

В синтезе лекарственных веществ (тиопентала,барбитуратов и др.) имеет огромное значениеалкилирование малонового (МЭ), ацетоуксусного (АУЭ), циануксусного эфиров (ЦУЭ) и других подобных соединений. Общаяхимическая схемаалкилирования этих веществ может быть представлена следующим образом:
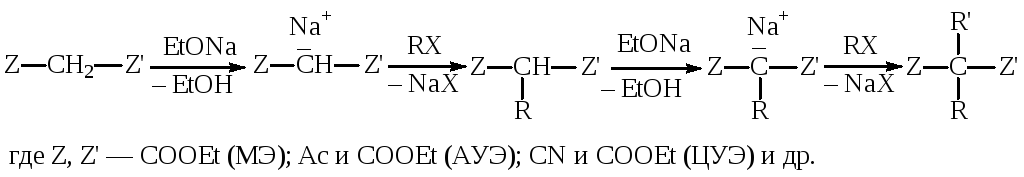
При последовательном действии на малоновый (ацетоуксусный, циануксусный) эфир металлического натрия или алкоголята натрия и алкилгалогенида один или оба водорода метиленовой группы замещаются на атомы натрия, а затем на радикал.
Замещенный малоновый эфир после гидролиза и декарбоксилирования превращается в одноосновные и двухосновные кислоты. Расщепление производных ацетоуксусного эфира концентрированной щелочью приводит к кислотам, а разбавленными щелочами или кислотами — к кетонам.

Механизм алкилированияможно рассматривать как электрофильное замещение, идущее через стадию отщепления протона с последующим присоединением электрофила. Однако эту реакцию чаще относят к нуклеофильному замещению уходящей группы в алкилирующем реагенте (SN1,SN2) либо присоединению по двойной связи и др.
Алкилирующими агентами в этой реакции чаще всего являются алкилгалогениды, непредельные соединения и диметилсульфат. Например, этилбромидом алкилируют малоновый эфир (в синтезетиопентала натрия и др.) и этиловый эфир фенилциануксусной кислоты (в производствефенобарбитала и гексамидина):
![]()

Диметилсульфат в присутствии алкоголятов используют при получении гексенала:

При получении -формилмасляной кислоты малоновый эфир алкилируют акролеином в среде четыреххлористого углерода в присутствии метилата натрия:

