
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
Глава 6. Процессы алкилирования
Алкилированием называются процессы замещения атома водорода или металла в молекуле субстрата на алкил. Обычно различаютС-, N- и О-алкилирование, которые несколько отличаются по условиям проведения процесса. Если в молекулу вводится арил, реакция называетсяарилированием.
В качестве алкилирующих агентов используют главным образом, галогенпроизводные, непредельные соединения, спирты, простые эфиры и эфиры серной и сульфокислот.
Процессы алкилирования используютдля построения углеродного скелета молекулы, а также временной защиты функциональных групп (чаще всего гидроксильной или аминогрупп при получении пептидов, антибиотиков или модификации сахаров). В связи с этим они имеют большое значение в химическом синтезе лекарственных веществ и витаминов.
Реакции С-, N- и О-алкилирования аренов и алифатических соединений сильно отличаются. Единого механизма, охватывающего все случаи этого процесса, нет. Поэтому рассмотрим их отдельно.
1. Алкилирование аренов по Фриделю-Крафтсу
С-Алкилирование аренов можно проводить по Вюрцу-Фиттигу, Вюрцу-Гриньяру и т.д., но в промышленности чаще всего используется реакция Фриделя-Крафтса, которую можно представить в виде следующей схемы:
![]()
Механизм реакции алкилирования аренов по Фриделю-Крафтсупредставляет собой обратимое электрофильное замещение (SE):

В кинетической области скорость реакцииможно рассчитать по уравнению:
![]()
в котором учитывается строение субстрата (k), концентрации реагирующих веществ и функция катализатора ().
Реакционная способность субстрата определяется устойчивостью-комплекса. Как и в других реакцияхSE(сульфирования, нитрования, галогенирования, нитрозирования и т. п.) электронодонорные заместители в ядре, стабилизирующие-комплекс, ускоряют реакцию, а электроноакцепторные — дестабилизируют его и затрудняют реакцию.
Существование -комплекса было доказано экспериментально (Ола, 1958 г.) при алкилировании мезитилена этилфторидом в присутствии BF3. При –80 °С образуется твердое оранжевое вещество, которое при –15 °С количественно превращается в конечный продукт:

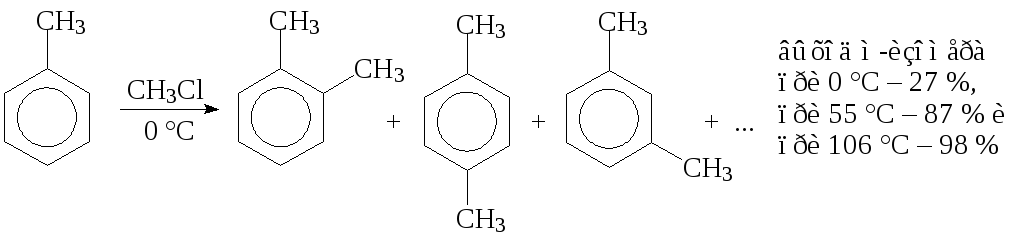
В связи с тем, что реакция обратима, направление реакции в мягких условиях определяетсяустойчивостью -комплекса (кинетический контроль) и выполняются правила ориентации. При высокой температуре, большом количестве катализатора и продолжительном времени ведения процесса направление реакции определяетсяустойчивостью конечных продуктов (термодинамический контроль), что часто приводит к получению метазамещенных продуктов. Например, при метилировании толуола метилхлоридом при 0 °С образуется 27 %м-ксилола, при 55 °C— 87 %, а при 106 °С — 98 %.
В качестве катализаторовв процессах алкилирования в основном применяют протонные и апротонные кислоты, оксиды, цеолиты и катиониты.
Протонные кислотыиспользуются главным образом при алкилировании ароматических соединений спиртами и алкенами. Ихактивность как катализаторов падает в рядуHF>H2SO4 >H3PO4.
В каталитических процессах применяют преимущественно безводный фтороводород как в жидком, так и в газообразном состоянии. Его каталитические свойства определяются ярко выраженной кислотностью и способностью к образованию комплексных соединений.
Фтороводород не является окислителем, легко отделяется от реакционной массы и утилизируется. Его низкая вязкость обеспечивает хорошее перемешивание и быстрое расслаивание реакционной массы. Однако большая летучесть, токсичность и коррозионная активность затрудняют использование HFв промышленных масштабах.
Применение серной кислотыкак катализатора процесса алкилирования осложнено ее высокой химической активностью.
Фосфорную кислоту применяют как в жидком виде, так и на твердом пористом носителе (пемзе, силикагеле, кварце, активированном угле, кизельгуре). Алкилирование в присутствии фосфорной кислоты протекает при повышенных температурах, но с высокой селективностью.
Высокой каталитической активностью обладают также пирофосфорная и полифосфорная кислоты, а также соли фосфорной кислоты: BPO4,Ca3(PO4)2,Na3PO4и др.
Апротонные кислоты (кислоты Льюиса) используются чаще всего при алкилировании алкилгалогенидами и алкенами. Поактивностиих можно расположить в следующий ряд:AlBr3 >AlCl3 >FeCl3 >BF3 >TiCl3 >ZnCl2 >TiCl4.
Галогениды алюминия представляют собой белые кристаллические вещества, растворимые во многих органических соединениях. Их растворы в эфире, ацетоне, спиртах являются активными катализаторами процессов алкилирования. Галогениды алюминия образуют димеры (Al2Hlg6), прочность которых падает от хлорида к иодиду. В связи с этим каталитическая активность бромида алюминия выше хлорида, так как активированный комплекс в реакции Фриделя-Крафтса образует мономерная форма.
Трифторид борапредставляет собой газ, растворяющийся в воде и некоторых органических растворителях. Он обладают комплексообразующей и кислотной активностью.
Оксиды металлов и бора (B2O3) в качестве катализаторов используют обычно послеобработки борной кислотой, трифторидом бора иактивации фтором. Наиболее активными оказались амфотерные оксиды(Al2O3,Cr2O3и др.), модифицированныеBF3.
Цеолиты имеют общую формулуM2/nО.Al2O3.xSiO2.yH2O, где М — металл, аn— его валентность.Каталитические свойства цеолитов можно менять. Для этого изменяют объем пор от 0,2 до 1,0 нм введением катионовLi+,Na+,K+,Ca2+и других методом ионного обмена; меняют алюмосиликатный составхSiO2:Al2O3, гдех≈ 36; а также добавляют вещества, обладающие кислотными свойствами. При этом, чем больше величинах, тем активнее цеолит.
Катиониты представляют собой полимеры (чаще всего полистирольные), содержащие –SO3H, –COOH, –PO(OH)2и другие группы.
Активностьтаких катализаторов определяется свойствами полимерной основы, степенью замещения кислотными группами (например, сульфирования), размерами катализатора, его пористостью, термической стабильностью и кислотностью.
Активность катализатора зависит также от строения субстрата, природы алкилирующего агента и условий реакции (температура, давление и т.д.). Например, трифторид бора является активным катализатором при алкилировании спиртами, алкенами, фторпроизводными, но в реакциях с другими алкилгалогенидами его активность мала.
Катализ может быть твердофазным и жидкофазным. Использование твердых гетерофазных катализаторов (оксидов, цеолитов, катионитов)предпочтительно, так как при этом упрощаетсятехнология процесса (отделение и регенерация катализатора); уменьшаютсязатраты на подготовку сырья, промывку реакционной массы и нейтрализацию кислых сточных вод; уменьшаетсякоррозияоборудования; упрощается организация непрерывных процессов и т.д. В случае апротонных кислот, выбор того или иного вида катализа зависит от растворителя и свойств кислоты Льюиса. При наличии двух жидких фаз (кислотно-солевой и органической) реакция, в основном, проходит в кислотно-солевом слое.
При алкилировании с помощью алкилгалогенидов и алкенов обычно достаточно небольшого количества катализатора, а при использовании спиртов необходимо, по меньшей мере, эквимолярное количество кислоты Льюиса, так как вода, образующаяся в результате реакции, дезактивирует катализатор.
Основными недостатками реакции Фриделя-Крафтса являются полиалкилирование, изомеризация радикала, изомеризация и диспропорционирование продукта.
Полиалкилирование объясняется большей реакционной способностью продуктов алкилирования, чем исходного субстрата:

Для увеличения выхода моноалкиларенареакцию ведут в избытке субстрата при возможно более низкой температуре.
Изомеризация радикалавызываетсяпревращением карбокатиона, образующегося в ходе взаимодействия галогенида с катализатором, в более стабильную частицу. Например, алкилирование бензола пропилбромидом в той или иной степени приводит к синтезу изопропилбензола, т.к. пропилкатион изомеризуется в более стабильный вторичный катион:

Чтобы избежать изомеризации радикала, следует тщательно подбирать условия проведения реакции (кислоту Льюиса, растворитель, время выдержки и температуру).
Изомеризация продукта реакции связана собратимостью процесса и смещением равновесия в сторону более устойчивых веществ. Например, при нагреваниип-ксилола с хлористым водородом иAlCl3, протон, выступая в качестве электрофила, атакуетп-положение субстрата и вытесняет карбокатион. Продуктами взаимодействия нового электрофила (СН3+) с толуолом являютсяо-,м- ип-ксилолы, которые вновь подвергаются атаке протона и т.д. При этом большая часть углеводорода превращаетсяв термодинамически более устойчивый м-ксилол, в котором метильные группы в наименьшей степени вытесняются протоном:

В ряде случаев использование в процессах алкилирования веществ, связывающих образующийся галогеноводород, предотвращает обратимость реакции, а, следовательно, и изомеризацию продукта.
Диспропорционированиепродуктов алкилирования также связано собратимостью реакции, поэтому одновременно сизомеризацией продукта может проходить иперемещение алкильных группв более замещенный арен:

В приведенном выше примере метилкатион в первую очередь реагирует с более активным чем толуол ареном (например, п-илим-ксилолом), поэтому в реакционной массе накапливаются моно- и триалкилбензолы.
Изомеризация и диспропорционирование конечного продукта в кислой среде может служить доказательством обратимости процесса алкилирования.
