
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
Замена атома галогена на группу -so3Na
В качестве реагентовв реакции Штреккера используютсульфитыкалия и натрия:
![]()
![]()
МеханизмреакцииSN2, поэтому в случае использованияпервичных алкилгалогенидов выходы сульфокислот составляют 70—90 %,вторичных— 20—25 %.Третичныеалкилгалогениды превращаются в олефины.
В реакцию вступают также галогензамещенные кислоты, спирты, кетоны и ароматические соединения с подвижным галогеном.
2. Нуклеофильное замещение сульфогруппы
При нагревании до 200—350 °С щелочные соли аренсульфокислот могут быть превращены в фенолы, амины, гидразины, тиолы, карбоновые кислоты или нитрилы:
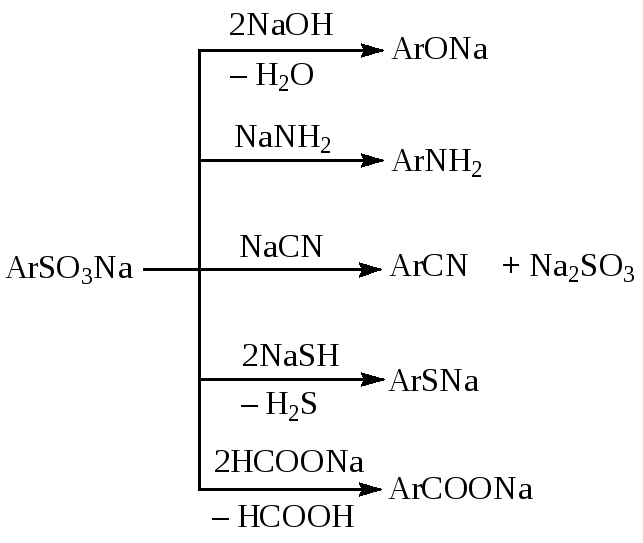
Особенно часто нуклеофильное вытеснение сульфогруппы используется для промышленного получения фенолов. Поскольку процесс обычно проводят со щелочью при высокой температуре, то он известен также под названиемреакции щелочного плавления.
Реакции щелочного плавления
Взаимодействие солей аренсульфокислот со щелочью протекает по уравнению:
![]()
Реакции идет по механизму нуклеофильного замещенияSNArи может быть изображена следующей схемой:

Реакционная способность исходных веществ зависит от устойчивости-комплекса, поэтому электронодонорные заместители во- ип-положениях к сульфогруппе затрудняют реакцию щелочного плавления, а электроноакцепторные — облегчают.
Активированная сульфогруппа замещается щелочью в более мягких условиях. Появление в молекуле субстрата даже слабых электроноакцепторов снижает температуру реакции на 50 и более градусов. Так, бензолсульфокислота обменивает сульфогруппу на гидроксил при 300—340 °С, а в синтезепрозеринащелочное плавление проводят при 275—290 °С.

Однако нитро- и хлорсульфокислоты ароматического ряда в реакциях щелочного плавления не используют вследствие образования значительного количества побочных продуктов. При наличии в молекуленескольких сульфогрупп можно подобрать температуру процесса и концентрацию щелочи таким образом, что замещаться будет только наиболее активированная сульфогруппа.
В зависимости от соотношения констант скоростей первой и второй стадий процесса реакция может иметь второй (первый по гидроксилу) или третий (второй по гидроксилу) порядок.Энергия активации велика и составляет 145—200 кДж/моль при 300—340 °С.
В промышленности используют несколько способов щелочного плавления:
«Открытое щелочное плавление» — это сплавление пасты натриевой или калиевой соли сульфокислоты со щелочью или ее концентрированным раствором при атмосферном давлении.
Автоклавное щелочное плавление проводится под давлением в автоклавах. В этом случае используют водные растворы солей сульфокислот. Метод применяется в тех случаях, когда нужно заместить гидроксилом лишь одну из нескольких сульфогрупп, имеющихся в молекуле исходного соединения. Этот метод используют также при щелочном плавлении аминосульфокислот, так как при проведении этого процесса открытым способом аминогруппа также замещается гидроксигруппой.
Автоклавное щелочное плавление с известьюиспользуется в тех случаях, когда обычные методы приводят к введению в ароматическое ядро двухорто-расположенных оксигрупп, как, например, в случае 2-антрахинонсульфоната натрия:


Иногда сплавление солей антрахинонсульфокислот со щелочью осуществляют в присутствии окислителей (например,NaNO3) при 200 °С (окислительный плав) для исключения восстановления антрахинона до гидроантрахинона.
Исходные вещества.Обычно для щелочного плавления применяют растворы илипасты солей сульфокислот, которые образуются после сульфирования. В качестве щелочи используютгидроксиды натрия, калия, кальция.
Щелочь — не только реагент, но и среда, в которой протекает превращение. Поэтому во многих случаях используетсяизбыток щелочи: от 2,1 до 3,5 моль на каждый моль соли сульфокислоты.
Едкий натрплавится при температуре 327,5 °С. Чтобы обеспечить подвижность плава при более низких температурах, используют 40—42 % или 70—73 % растворы щелочи, которые затем упаривают до 80—85 %, или же добавляют в щелочь небольшое количество воды. Так, едкий натр, содержащий 10 % воды, плавится при температуре 270—290 °С. В процессе плавки вода испаряется, и температура массы поднимается.
В том случае, когда едкий натр оказывается недостаточно реакционноспособным, используют более активную, но и более дорогую щелочь КОН (едкое кали), температура плавления которой 380—385 °С. Чтобы снизить температуру реакции, часто используют смесь гидроксидов натрия и калия. При содержании гидроксида калия в смеси 20 % она плавится при 300 °С.
Концентрация щелочи и температура ведения реакции — важнейшие параметры реакции, определяющие результат щелочного плавления.
Обработка готового щелочного плава включает: разбавление, нейтрализацию избыточной щелочи, отделение сульфита, выделение и очистку гидроксисоединений.
После завершения реакции осуществляют гашение щелочного плава — разбавление щелочного плава водой. Степень разбавления реакционной массы зависит от способа выделения сульфита натрия.
Для выделения сульфита натрия в твердом состоянии, к плаву добавляют строго определенное количество воды, полученную массу нагревают до 80—90 °С, а затем сульфит отфильтровывают и промывают на фильтре. Гидроксисоединение выделяют подкислением щелочных маточников. Таким методом пользуются, например, при получении фенола и 2-нафтола.
В тех случаях, когда сульфит отделяют в виде раствора, плав разбавляют (гасят) большим количеством воды, достаточным для его полного растворения. Затем добавляют кислоту для нейтрализации избытка щелочи и полного выделения оксисоединения, которое отделяют от раствора сульфита отстаиванием или фильтрацией.
В некоторых случаях более выгодно проводить разложение сульфита кислотой:
![]()
Для полного удаления сернистого газа из реакционной массы процесс проводят при 80—100 °С и хорошем перемешивании. Выделяющийся сернистый газ поглощают раствором щелочи таким образом, чтобы получить сульфит натрия, который используется в качестве сырья во многих производствах.
Аппаратура в процессах щелочного плавления работает в очень тяжелых условиях. Металл под действием расплавленных щелочей в присутствии органических веществ покрывается мельчайшими трещинами межкристаллитной коррозии и становится хрупким. Лучше всего эти условия выдерживает никель. Однако из чистого никеля аппаратуру делают редко, так как она получается слишком дорогой. Обычно котлы для щелочного плавления изготавливают из легированного чугуна или легированной стали, содержащей никель, хром и молибден в качестве легирующих присадок. Однако даже в этом случае срок службы плавильных котлов не превышает 2—3 лет. Вследствие необходимости поддержания высокой температуры обогрев плавильных котлов обычно ведется топочными газами. В районах с дешевой электроэнергией можно использовать также электрообогрев. Для предотвращения пригорания щелочного плава при подвижных плавах используют пропеллерные мешалки, а при вязких — якорные. Для щелочной плавки под давлением применяются обычные автоклавы.
Гашение плава проводят в стальных котлах с рамными или лопастными мешалками.Аппараты для подкисления разбавленного плава обязательно должны быть защищены от кислотной коррозии — футерованы или освинцованы.
