
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
Замена атома галогена на аминогруппы
В алкилгалогенидахзамена галогена на аминогруппу осуществляется нагреванием их со спиртовым, водным или водно-спиртовым раствором аммиака, первичного или вторичного амина под давлением в автоклаве. При этомобразуется смесь первичных, вторичных, третичных аминов и четвертичных солей аммония:
![]()


Третичные алкилгалогениды в этих условиях образуют алкены и для алкилирования аминов обычно не применяются.
Температура реакции зависит от активности галогенида и нуклеофила и колеблется в широких пределах (50—150 °С).
Основным недостатком приведенного метода получения аминов является полиалкилирование, которое обусловлено повышением нуклеофильности реагентов от аммиака к третичному амину. Выход первичного амина можно повысить, применяя большой избыток аммиака и добавляя карбонат или хлорид аммония. Однако даже в этом случае образуется смесь соединений, которые приходится разделять. Лишь α-галогенкарбоновые кислоты при действии большого избытка концентрированного водного раствора аммиака и карбоната аммония при 40—50 °С образуют α-аминокислоты (первичные амины) с выходом 60—70 %. Для примера приведен синтез аланина:

Среди селективных методов получения аминовиз алкилгалогенидов, наиболее широко применяемых в синтезе БАВ, необходимо отметить:
Синтез первичных и вторичных аминов из амидов сульфокислот:


Синтез первичных аминов по Габриэлю из фталимида:

Гидролиз N-алкилфталимида осуществляют водными растворами кислот или оснований при высоких температурах под давлением.

Иногда для выделения аминов используют гидразинолиз, который идет при нормальном давлении.
Синтез вторичных аминов из азометинов и алкилгалогенидов:

В неактивированных галогенаренах замена галогена осуществляется действием раствора аммиака при высокой температуре (~ 200 °С) и давлении в присутствии катализатора (Cu2O,Cu2Cl2и т.д.) через образование медного комплекса, или действием амида натрия в жидком аммиаке в более жестких условиях через образованиедегидробензола. Примером может служить синтез 3,4-ксилидина в производстверибофлавина:

В активированных галогенаренах условия замены галогена зависят от его реакционной способности:

Замена галогена на аминогруппу в ацил- и сульфонилгалогенидах (синтез амидов приведен здесь для сравнения подвижности галогенов) идет, как правило,в очень мягких условиях. Например, при полученииметилуретана, фенилуретилана, сульфаниламидных препаратов, азидина,и других полупродуктов и лекарственных веществ:
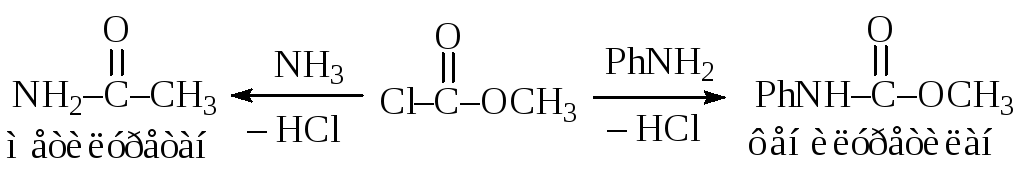
![]()
Замена атома галогена на цианогруппу
Нитрилы являются важными промежуточными продуктами в синтезе многих химико-фармацевтических препаратов. Они легко превращаются в амиды карбоновых кислот, карбоновые кислоты, амины. При использовании алифатических галогенидов это относительно простой способ удлинения углеродной цепи:

![]()
Цианид-ион является амбидентным ионом,поэтому реакция может идти по двум направлениям — с образованием нитрилов и изонитрилов:

Первичные алифатические и бензилгалогениды в спиртах и водно-спиртовых смесях практически не образуют примесь изонитрилов. Небольшие количества изонитрила, которые легко обнаруживаются по крайне неприятному запаху, можно гидролизовать в кислой среде и таким образом отделить от основного продукта. Нитрилы гидролизуются в значительно более жестких условиях.
Выходыалифатических нитрилов при использованиипервичных алкил-, бензил и аллилгалогенидовхорошие (до 90 %). В случаевторичных— средние (до 60—70 %). Стретичнымигалогенидами в этих условиях идет реакция элиминирования, поэтому метод неприменим для пространственно затрудненных субстратов.
Реакцию в алкилгалогенидах можно проводить избирательно,учитывая разную подвижность галогенов (Cl<Br<I):
![]()
Правильный выбор растворителяво многом определяет успех реакции галогенида с цианидом. В случае реакционноспособных алкилгалогенидов используют сухой ацетон с добавлением небольшого количества иодида натрия. При использовании инертных галогенидов реакцию ведут в 70—90 % спирте или триэтиленгликоле. Наилучшие результаты дают биполярные апротонные растворители (например, диметилсульфоксид, диметилформамид).
Реакцию используют для получения циануксусной и малоновой кислот (в производствахтеобромина, теофиллина, кофеинаи др.), для синтеза замещенных бензилцианидов и цианметилирования вератрола (синтезхлоридина, папаверина и др.):

![]()
Цианметилирование вератрола (синтез папаверина) идет как минимум в две стадии: на первой стадии образуется 3,4-диметоксибензилхлорид, который взаимодействует с цианидом натрия и превращается в нитрил:

В случае ароматических галогенидов синтез соответствующих фенилцианидов следует вести в апротонных растворителях при нагревании до 200 °С с цианидом меди (I) в пиридине:
![]()
Замещение галогена на цианид-ион в условиях межфазного катализа повышает выход продукта на 15—20 % даже по сравнению с реакциями в диполярных апротонных растворителях.
Например, из втор-октилхлорида в условиях МФК втор-октилцианид образуется с выходом 85—90 %, ав ДМСО выход только 70 % (остальное — продукты элиминирования).

Выход цианистого бензила, важного полупродукта в синтезе целого ряда лекарственных препаратов, по традиционной технологии (75 % водный этанол, 76—78 °С) составляет 77—79 %. При этом вкачестве примесей образуются бензиламин, бензиловый спирт, бензиловый эфир фенилуксусной кислоты и другие вещества, что затрудняет отделение и очистку целевого продукта.

Цианирование хлористого бензила в двухфазной системе С6Н5СН2Cl– водный растворNaCNпозволило увеличить выход продукта реакции до 95—96 %.
В качестве катализаторов процесса в настоящее время используют бензилтриэтиламмоний хлорид или бензилдиметилформиламмоний хлорид, которые образуются непосредственно в реакционной массе, при добавлении триэтиламина или диметилформамида:
![]()

