
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
1. Химизм процесса и краткая характеристика продуктов реакции
Реакции нитрозированияможно представить следующей химической схемой:

Большинство процессов нитрозирования формально можно отнести к реакциям электрофильного замещения, т.к. нитрит натрия в кислой среде образуетэлектрофильные частицы.
При взаимодействии солей нитрита натрия с минеральными кислотами образуется азотистая кислота, которая частично протонируется с образованием активной электрофильной частицы нитрозацидий-катиона (H2NO2+). Однако, в водном растворе этот катион гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с амином, образуякатион нитрозония NO+, нитрозилгалогенид NOHlg, азотистый ангидрид N2O3, которые и нитрозируют субстрат:

Соотношение активных частиц в реакционной массе зависит от кислотности среды и природы минеральной кислоты. При проведении реакциив соляной кислоте основной нитрозирующей частицей является нитрозилхлоридNOCl, ав среде серной кислоты — азотистый ангидридN2O3. Катион нитрозонияNO+в заметных количествах образуется лишьв концентрированной серной кислоте. Активность перечисленных частиц уменьшается в ряду: катион нитрозония > нитрозилхлорид > азотистый ангидрид.
Реакция диазотирования протекаетпо уравнению:
![]()
Механизм реакции можно представить следующей схемой:

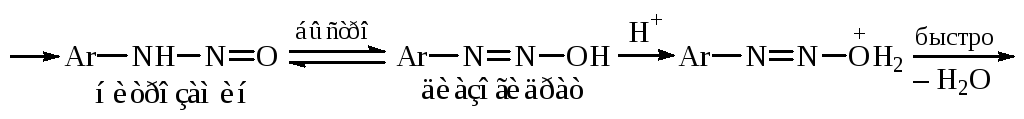

![]()
Лимитирующей стадией процесса являетсянитрозирование, поэтомускорость реакции зависит от рКа амина и кислотности среды.Поскольку в кислой среде амин находится в состоянии динамического равновесия с солью, реакция идет тем быстрее, чем в большей степени равновесие смещено в сторону свободного основания.
![]()
Соли арендиазония в водных растворах минеральных кислот при низкой температуре (0—10 °С)относительно устойчивыиполностью диссоциированы. Это связывают с равномерностью распределения электронного облакакатиона, структуру которого можно представить в виде следующих граничных структур:


В связи с этим электронодонорные заместители в орто-ипара-положениях к диазогруппе участвуют в распределении положительного заряда и увеличивают устойчивость диазокатиона, а электроноакцепторные — уменьшают.

В сухом кристаллическом состоянии при нагревании или ударе соли диазония иногда разлагаются со взрывом. При необходимости они могут быть стабилизированы в виде двойных солей металлов или в виде солей ароматических сульфокислот:


Соли алкандиазония, полученные из первичных алифатических аминов,неустойчивы. Электронное облако катиона неравномерно распределено по частице, поэтому катион отщепляет азот, превращается в карбониевый ион и далее в спирт, алкен и другие стабильные продукты:
![]()
В случае метиламина, а также соединений, имеющих вα-положении заместители с сильным I-эффектом, образуютсяустойчивые алифатические биполярные ионы диазонияза счет отщепления протона от радикала. Например, диазометан и диазоуксусный эфир (этиловый эфир диазоуксусной кислоты) в большей мере отвечают структуре:

![]()
N-Нитрозирование наблюдается при взаимодействии вторичных аминов с азотистой кислотой, в результате чего образуютсяN-нитрозосоединения,которые не могут изомеризоваться в диазогидрат:

N-Нитрозамины — токсичные, неустойчивые соединения. Они разлагаются уже при комнатной температуре.N-нитрозарилалкиламины могутизомеризоватьсявС-нитрозосоединения (перегруппировка Фишера-Хеппа):

Миграция нитрозогруппы в п-положение представляет интерес для синтеза С-нитрозосоединений, т.к. прямое нитрозирование по атому углерода вторичных ароматических аминов не проходит.
Перегруппировка хорошо идет только под действием HCl. При этом образуются исключительнопара-замещенные производные бензола. В связи с тем, что перегруппировка идет и в большом избытке мочевины, которая поглощает электрофильные частицыNO+илиNOCl, можно предположить, что она имеет внутримолекулярный характер.
С-Нитрозирование возможно как для активированных аренов, так и алифатических соединений.
Ароматические соединения, содержащие сильные электронодонорные заместители (третичные жирноароматические амины и фенолы), взаимодействуют с нитрозирующими частицами по механизмуэлектрофильного замещения (SE) у атома углерода.
В случае производных бензола нитрозогруппа почти всегда замещает атом водорода в пара-положении к ОН- илиNR2-группе. Продукт реакции, как правило, выделяется в виде интенсивно окрашенного осадка:


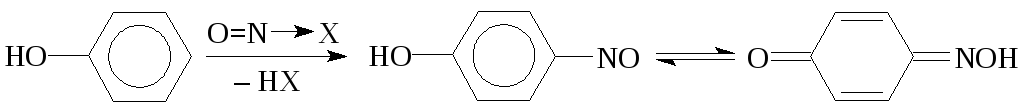
В ряду нафталина чаще образуется смесь изомеров. Например, при нитрозировании α-нафтола получаются почти равные количества 1-гидрокси-2-нитрозонафталина и 1-гидрокси-4-нитрозонафталина.

С-нитрозирование алифатических соединений протекает по радикальному механизму SR. Из насыщенных углеводородов таким образом получают нитрозоалканы, которые неустойчивы и легко перегруппировываются в изомерные оксимы. Например, в синтезе лизина и-аминокапроновой кислоты используют следующую реакцию:
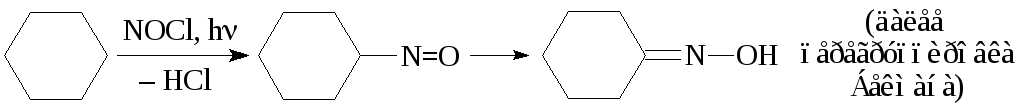
О-Нитрозирование осуществляют взаимодействием спирта с азотистой кислотой.
![]()
Алкилнитритыполучают также действием нитритов на алкилгалогениды:
![]()
Алкилнитриты при комнатной температуре медленно разлагаются, на свету низшие нитрозоэфиры могут взрываться. В кислой среде они легко гидролизуются, что позволяет использовать их в качестве мягких нитрозирующих агентов (для получения малостабильных солей диазония, дезаминирования алкиламинов, нитрозирования фенолов и СН-кислот и т. п.)
