
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
Нитрование концентрированной азотной кислотой в уксусном ангидриде применяютдля нитрования активных и ацидофобных аренов. Следует отметить, что это, пожалуй, единственный метод, позволяющий успешно нитровать ацидофобные соединения.
При смешении концентрированной азотной кислоты с уксусным ангидридом образуются нитрующие частицы. Добавление каталитических количеств серной кислотыускоряетэту реакцию:
![]()

Нитрующими частицами являются (в порядке возрастания активности)ацетилнитрат, который способен к электрофильной атаке за счет поляризации молекулы,протонированная форма ацетилнитратаинитроний-катион, концентрация которого крайне мала:

Вместо уксусного ангидрида в некоторых случаях используются ангидриды других кислот, например, бензойной.
Степень превращения азотной кислоты в ацетилнитрат зависит от температуры. При 20 °С превращение происходит на 75 % (в конц.HNO31 % нитроний-катиона), но при –10 °С ацетилнитрат не образуется.
Достоинства метода:высокаяконцентрациянитрующих частиц; возможность нитрованиямалоустойчивыхиацидофобныхсоединений; высокий выход; замещение идетселективно, преимущественно во-положение.
Основным недостаткомявляетсяопасность процесса. Несоблюдение режима смешения азотной кислоты и уксусного ангидрида приводит к образованию не только ацетилнитрата, но и рядапобочных продуктов, обладающих взрывчатыми свойствами. Известны случаи, когда ацетилнитрат взрывался не только при нагревании, но и на холоду.
Метод используют:
При нитровании мезо-3,4-дифенилгексана (получение курареподобного препаратапарамиона):

При нитровании пятичленных гетероциклов с одним гетероатомом и их производных, которые в средах с сильными кислотами расщепляются и образуют смолы.Нитрованиефурана ацетилнитратомидет с высоким выходом при температуре до 5 °С:

Нитрование аренов солями азотной кислоты в уксусном ангидриде(реакция Менке) являетсяразновидностьюпредыдущего метода, но более безопасным.
Нитровать можно разными солями азотной кислоты. Реакция идет при невысоких температурах, без осмоления, с высокой селективностью.
Например, из анилина при действии нитрата медив среде уксусного ангидрида образуется толькоо-нитроацетанилид, а при действиинитрата лития— толькоп-нитроацетанилид.
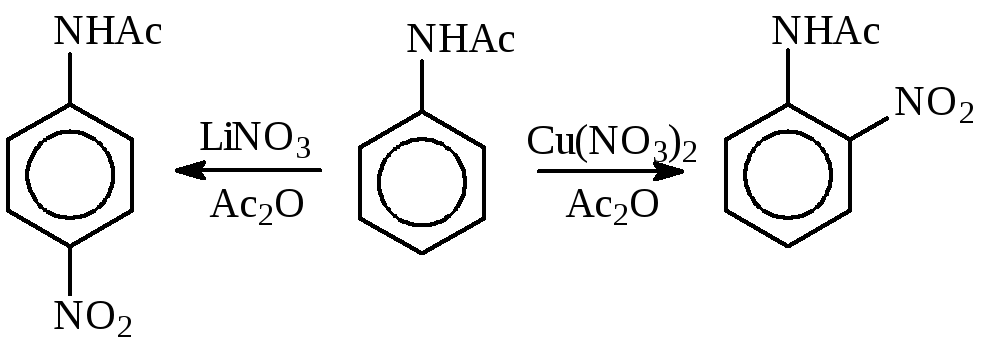
Наибольшая скорость нитрования достигается при использовании смеси нитратов меди (II) и железа (III).

Прибавление ледяной уксусной кислоты способствует более спокойному течению реакции. В некоторых случаях уксусный ангидрид можно полностью заменить уксусной кислотой. Например, из фенола при действии нитрата меди и ледяной уксусной кислоты образуется толькоо-нитрофенол.
8. Нитрование разбавленной азотной кислотой
Разбавленная азотная кислота, в которой практически полностью отсутствуют ионы нитрония, может использоваться для введения нитрогруппы в молекулы активных аренов (фенолов и аминов). Однако эту реакцию нельзя отнести к нитрованию, так как синтез нитросоединений проходитпо схеме «нитрозирование–окисление».
![]()
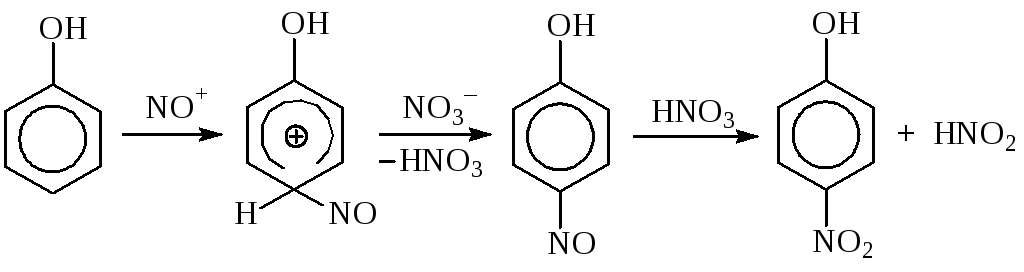
Для реакции достаточно наличия лишь следов азотистой кислоты, так как она регенерируется на стадии окисления нитрозосоединения. Нитрозокатион NO+менее активный электрофил, чемNO2+~ в 1014раз, поэтому этот метод синтеза нитросоединений применим только в случае очень активных аренов.
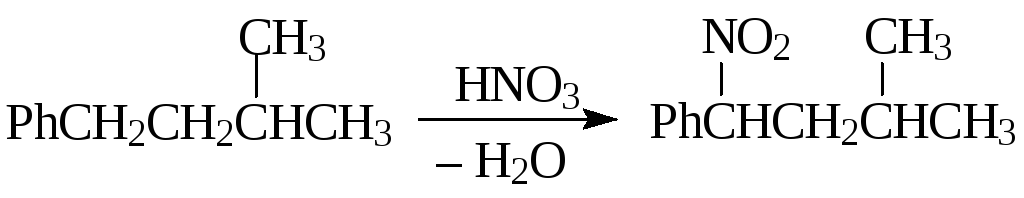
Разбавленная азотная кислота широко применяется для нитрования алканов и алкиларенов в боковую цепь(М.И. Коновалов).
![]()
Реакция идет по радикальному механизму и значительно медленнее, чем электрофильное нитрование ароматических углеводородов.
Один из возможных путей протекания реакции в отсутствие инициаторов можно представить следующей схемой:
![]()
![]()
![]()
![]()
![]()
Реакция ускоряется при добавлении инициаторовначальной стадии образования свободных радикаловR..Цепной механизм характерен для нитрования алканов. В случае нитрования в боковую цепь аренов реакция, как правило, идет с обрывом цепи и заканчивается рекомбинацией радикалов R.иNO2..
Направление реакции и реакционная способность нитруемых соединений определяется устойчивостью образующихся радикалов, поэтому жирно-ароматические соединения в первую очередь нитруются в α-положениебоковой цепи, а алканы — потретичномуатому углерода.

Повышение температурыснижает селективность и ведет к образованию полинитросоединений. Поэтому из 2-нитропропана можно с высоким выходом получить 2,2-динитропропан:
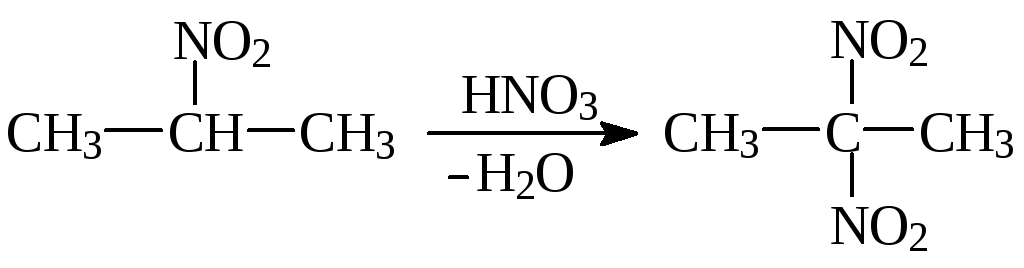
Следует отметить три основных промышленных способа нитрования алканов: 1) в газовой фазе при 350—400 °С с помощью 40—70 %-ной азотной кислоты; 2) в жидкой фазе при 100—200 °С под действием 50—70 %-ной азотной кислоты; 3) окислами азота.
Высокотемпературное газофазное нитрование всегда сопровождается деструкцией углеродной цепи и образованием низших нитроалканов. Таким образом, нитрование алканов является процессом низкоселективным.
Прямое нитрование алканов приводит к получению сложной смеси продуктов и проходит в жестких условиях. В связи с этим весьма распространенным методом получения нитроалкановявляетсявзаимодействие алкилгалогенидов с нитрит-ионом

Реакции SN2 идут по наиболее нуклеофильному центру нитрит иона, и продуктом является нитроалкан. Карбкатион (SN1 механизм) взаимодействует с наиболее электроотрицательным атомом и образуется алкилнитрит. Поэтому третичные алкилгалогениды этим путем в нитроалканы не превращаются. Как правило, из хлоридов получаются нитроалканы, а из бромидов и иодидов с нитритом серебра — алкилнитриты.
