
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
5. Нитрование концентрированной азотной кислотой
Метод нитрования концентрированной азотной кислотой используется значительно реже, чем нитрование нитрующей смесью.
Достоинство метода — не надо регенерировать серную кислоту.
Недостатками метода являются: низкаяконцентрация нитроний-катиона; быстро теряетсяреакционная способность при разбавлении водой, выделяющейся в процессе нитрования; сильное окислительное действие азотной кислоты, которая более сильно по сравнению с нитрующей смесьюреагирует с черными металлами;расход азотной кислоты обычно в 1,5 раза выше теоретического.
Однако, учитывая относительно невысокую цену на азотную кислоту, высокую стоимость и малый тоннаж многих лекарственных веществ, этот метод нитрования часто используют в химфармпредприятиях, на которыхэкономически невыгодно организовывать регенерацию отработанной серной кислоты
Метод применяют, как правило, для нитрованияактивированных аренов, либо дляО-нитрования.Этим методом нитруют п-цимол, тетралин, ксилол. Первичные ароматические амины нитруют после защиты аминогруппы. Фенилуксусная и коричная кислоты нитруются, главным образом, в п-положение.

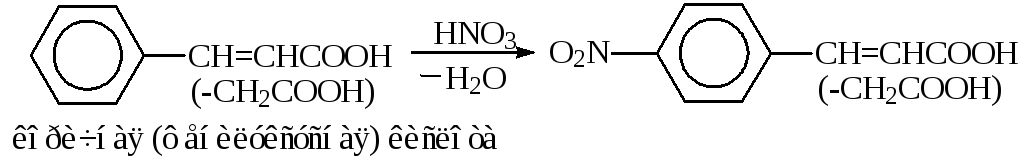
В синтезе левомицетинаконцентрированную азотную кислоту используют при получении «нитроэфира» (С- иО-нитрование при3 °С, «прямой слив»):

По другой методике получение нитроэфира ведут методом «обратного слива» в избытке азотной кислоты при температуре 8—12 °С. Дальнейшее повышение температуры нитромассы недопустимо, так как она может разлагаться со взрывом.
При получении нитросорбида используют 98 %-ную азотную кислоту:

Устранение недостатков метода связано, прежде всего, с уменьшением окислительных свойств кислоты и увеличением концентрации электрофильных частиц.Поэтому, чем выше концентрация азотной кислоты и ниже температура нитрования аренов, тем реакция идет быстрее именьше сопровождается окислением. Кроме этого используют:
1. Кислоты Льюиса в качестве катализаторов для увеличения концентрации электрофильных частиц.
2. Нитрование азотной кислотой в среде инертного органического растворителя, чтопозволяет:
уменьшить окислительное действие азотной кислоты, подбирая растворитель таким образом, чтобы в нем растворялись исходные вещества, и не растворялся продукт реакции;
регулировать концентрацию нитроний-катиона, а, следовательно, и скорость реакции полярностью и количеством растворителя (чем более полярный растворитель, тем быстрее идет реакция);
катализировать процесс добавлением небольших количеств сильных кислот. Например, добавка 0,001 моль/л H2SO4увеличивает скорость нитрования бензола в нитрометане в 2 раза, а 0,01 — в 30 раз.
Необходимо при этом учитывать, что многие растворители, явно нереагирующие с азотной кислотой, образуют с ней комплексные соединения.
3. Нитрование концентрированной азотной кислотой с азеотропной отгонкой воды из реакционной массы идет при температуре кипения азеотропной смеси ипостоянной концентрации электрофила. Нитрование проводится минимально необходимым количеством азотной кислоты.
6. Нитрование смесью азотной и уксусной кислот
Метод, по сути, является разновидностью нитрования концентрированной азотной кислотой в инертных растворителях, где растворителем является уксусная кислота, которая, прежде всего, снижает окислительную активность азотной кислоты.
Достоинствами метода являются:низкая окислительная активностьреагентов,легкость регулирования нитрующей активностиреагентов, поэтому можно нитровать активированные арены,большая селективностьреакции, чем в среде серной кислоты, что позволяет увеличить выход нитросоединения.
Этим методом нитруют активные арены:производные бензола (например, фенол, гидроксибензальдегид, салициловую кислоту), производные нафталина (гидроксинафтойную кислоту), антрацен и другие.
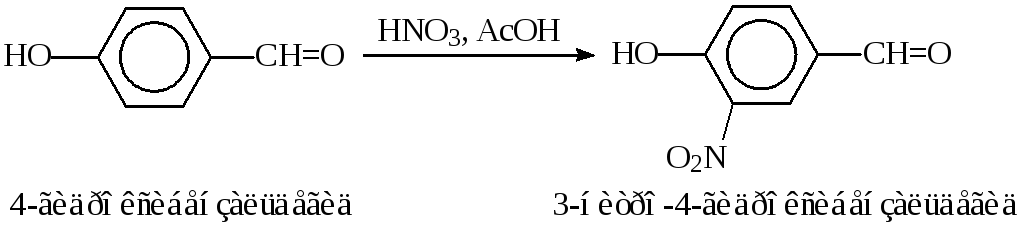
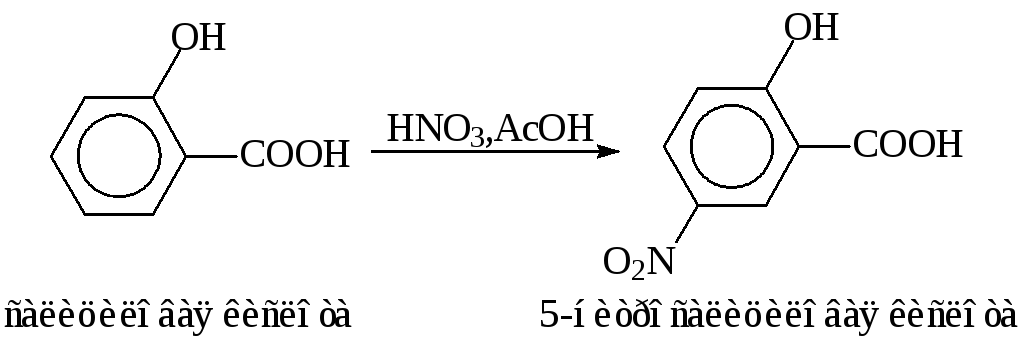
Ароматические аминынитруют после предварительного ацилирования уксусным ангидридом. Для предотвращения процесса нитрозирования примесь азотистой кислоты удаляют мочевиной:
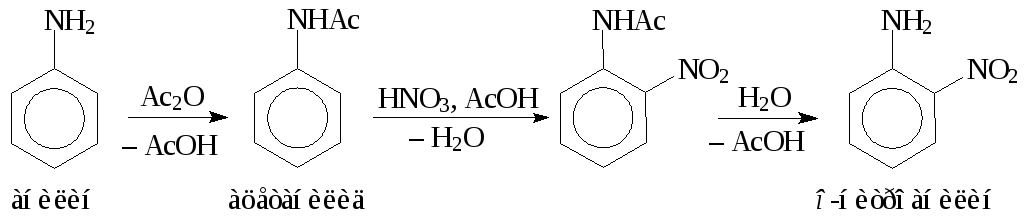

При получении нитроанилина анилин обрабатывают смесью уксусной кислоты и уксусного ангидрида, а затем к полученному раствору ацетанилида добавляют смесь концентрированной азотной кислоты и мочевины в ледяной уксусной кислоте. После выдержки при комнатной температуре технический продукт осаждают разбавлением нитромассы водой при 0 °С. Выход технического нитропродукта около 90 %. Разделение о- ип-нитроанилина основано на различной растворимости и различной скорости омыленияо- ип-нитроацетанилидов.
Если при нитровании ацетанилида серно-азотной нитрующей смесью образуется главным образом п-нитроацетанилид, то при нитровании в среде уксусной кислоты в качестве основного продукта образуетсяо-нитроацетанилид.
