
- •Передмова
- •Класифікація електродів
- •Можливість гідролізу
- •Прогнозування конпропорціонування (конмутації)
- •Передбачення явищ дисмутації
- •Витіснення водню
- •Окиснення киснем повітря
- •Виділення кисню
- •Окисно-відновні реакції між сполуками одного елементу
- •Обмеження застосування діаграми Пурбе
- •Роль середовища в окисно-відновних реакціях
- •Вплив природи розчинника на окисно-відновні реакції
- •Роль кінетичного фактора в окисно-відновних реакціях
4FeO42-+20H+=4Fe3++3O2+10H2O
Внаслідок ефекту пасивування окиснення металів киснем має місце далеко не завжди.
Окисно-відновні реакції між сполуками одного елементу
Якщо при деякому рН форма існування одного елемента лежить помітно (хоча б на 0,2 В) вище форми існування іншого елемента, то вище розміщена форма окиснить ту, що знаходиться нижче на діаграмі Пурбе. При цьому утворюються форми, область існування яких знаходиться посередині між вихідними формами.
Приклад. Область існування MnО4– (діаграма для Мангану) лежить вище, ніж область існування Fe2+ (діаграма для Феруму). Значить, MnО4– може окиснити катіон Fe2+. У кислому середовищі при цьому утворюється Fe3+ і (залежно від співвідношення реагентів) MnО2 або Mn2+:
MnО4– + 3Fe2+ + 4H+ = MnО2 + 3Fe3+ + 2H2O
MnО4– + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
У нейтральному середовищі утворюються MnО2 і Fe(OH)3: MnО4– + 3Fe2+ + 7H2O = MnО2 + 3Fe(OH)3 + 5H+
Обмеження застосування діаграми Пурбе
Діаграма Пурбе відображає тільки термодинамічно стійкі форми. Кінетично стійкі (вони ж метастабільні) форми на ній не відображаються. Тому вона не може бути використана для передбачення утворення метастабільних форм. Наприклад така форма, як гіпохлорит-йон OCl- метастабільна (нестійка термодинамічно, але диспропорціонує вкрай повільно). Тому на діаграмі Пурбе для хлору її немає і передбачити її утворення (зокрема, при диспропорціонуванні хлору) за діаграмою Пурбе неможливо:
Cl2 + 2OH– = Cl– + ClО– + H2O
Крім того, далеко не всі процеси, передбачені діаграмою Пурбе, мають досить велику швидкість, щоб бути помітними.
Запитання і завдання для самостійного виконання
1. Побудуйте діаграму Латимера для Мангану в лужному середовищі. Визначите: а) у яких ступенях окиснення Манган буде зазнавати
45

диспропорціонування в лужному водному розчині; б) найбільш стійкий ступінь окиснення Мангану у водному розчині з лужним середовищем і поясніть причини нестійкості інших ступенів окиснення.
2.На основі діаграми Латимера для Ауруму визначите: а) який з йонів
–дибромоаурат(I) або тетрабромоаурат(III) – більш стійкий у водному розчині і чому; б) чи стабілізується стан Au(I) при утворенні комплексного диціаноаурат(I)-йону.
3.Побудуйте діаграми Латимера та Фроста для обраних вами довільно елементів.
Константахімічноїрівновагиокисно-відновної реакції
Зручною характеристикою для оцінки глибини протікання будь-якої реакції є константа хімічної рівноваги. Константу рівноваги окисновідновної реакції можна розрахувати з даних про електродні потенціали.
Скористаємося добре відомими співвідношеннями: |
|
ΔG° = – RT lnKred/ox |
(10) |
ΔG° = – nFEо, |
(11) |
де ΔG° – стандартна зміна ізобарно-ізотермічного |
потенціалу (вільної |
енергії) Гіббса; Kred/ox – константа хімічної рівноваги окисно-відновної
реакції; n – число електронів, що беруть участь в окисно-відновній реакції; F – число Фарадея; E° = ϕо = ϕоox – ϕоred - різниця стандартних електродних потенціалів.
Зі співвідношень (10) і (11) випливає: .
(12)
Розглянемо приклади розрахунків константи хімічної рівноваги.
Завдання 1. Розрахувати константу хімічної рівноваги реакції: H3AsO4 + 2HI = HAsO2 + I2 + 2H2O.
Розв'язок. Запишемо йонно-електронні рівняння реакцій і стандартні потенціали електрохімічних систем, при взаємодії яких здійснюється цей
процес: |
|
|
а) H3AsO4 + 2H+ + 2ē = HAsO2 + 2H2O |
ϕ° = 0,56 |
В ; |
б) I2 + 2ē = 2I– |
ϕ° = 0,54 |
В. |
Як система-окисник в цій реакції виступає система а, у ролі |
||
відновника – система б. |
|
|
E° = ϕо = ϕоox – ϕоred = 0,56 – 0,54 = 0,02 |
(В). |
|
Kred/ox > 1, отже, рівновага зміщена в прямому напрямку. |
|
|
46
Завдання 2. Розрахувати константу хімічної рівноваги окисновідновної реакції:
Розв'язок2KMnO.4 + 5K2S + 8H2SO4 = 2MnSO4 + 5S + 6K2SO4 + 8H2O.
2MnO4– + 5S2– + 16H+ = 2Mn2+ + 5S + 8H2O. |
||
2MnO4– + 8H+ +5ē = Mn2+ + 4H2O |
ϕo = |
1,51 B; |
S + 2ē = S2– |
ϕo = |
–0,48 B. |
E° = ϕо = ϕоox – ϕоred = 1,51 – (–0,48) = 1,99 (В).
Число електронів, що беруть участь в окисно-відновній реакції n = 10.
Із урахуванням |
цього за співвідношенням (12) |
знаходимо, що Kred/ox = |
|
= 10337 >>1, тобто реакція йде практично необоротно в прямому напрямку. |
|||
Наведені |
розрахунки |
показують, що |
поява в окисно-відновній |
системі навіть |
невеликого |
значення електрорушійної сили реакції (Eо) |
|
призводить до суттєвого зміщення хімічної рівноваги. Для випадків, коли відмінність в електродних потенціалах електрохімічних систем суттєва:
Kred/ox >> 1 або Kred/ox << 1, реакція йде практично до кінця в прямому, або в зворотному напрямках.
Запитання і завдання для самостійного виконання
1.Запишіть рівняння Нернста та поясніть зміст його складових. Який вигляд має це рівняння за стандартної температури?
2.Запишіть вираз рівняння Нернста для електродних процесів:
а) MoO42–+ 8H+ + 6ē = Mo + 4H2O б) Cl2↑ + 2ē =2Cl–
в) S2O82– + 2ē = 2SO42–
г) P↓ + 3H2O + 3ē = PH3↑ + 3OH–
д) Cr2O72– + 14H+ +6ē = 2Cr3+ + 7H2O.
3. Чи можливе подальше окиснення бромід-йонів Калій перманганатом, якщо [H+] = 10–5 моль/л; [Mn2+] = [MnО4–] = [Br–]= 1 моль/л?
4. Розрахуйте ЕРС гальванічного елемента:
Zn | ZnSO4 || ZnSO4 | Zn 0,001М 1М
5.Чому дорівнює значення електродного потенціалу водневого електроду при pН = 3?
6.Розрахуйте константи хімічної рівноваги окисно-відновних
реакцій:
а) 3FeCl3 + NO + 2H2O = 3FeCl2 + HNO3 + 3HCl б) 3Cl2 + 2NO + 4H2O = 6HCl + 2HNO3
в) 2Cu(NO3)2 + 4KI = 2CuI + I2 + 4KNO3 г) 2FeCl3 + 2HBr = 2FeCl2 + Br2 + 2HCl
д) 2Mn(NO3)2 + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
47

Які з наведених реакцій практично не йдуть у прямому напрямку?
7. У початковий момент часу в реакційній суміші при T = 298 K перебували 0,1 М NH2OH і 0,1 М KI при pH = 7. Визначити рівноважну концентрацію продуктів їх взаємодії за реакцією:
NH2OH + 2KI + 2H2O = NH4OH + I2 + 2KOH.
Фактори,щовизначаютьнапрямок іглибину протіканняокисно-відновнихпроцесів
Фактори, що впливають на глибину протікання окисно-відновних реакцій, можна встановити проаналізувавши рівняння Нернста. До них належать:
1.Природа реагуючих речовин.
2.Активність (концентрація) усіх речовин, що присутні в окисновідновній системі.
3.Температура розчину.
4.Кислотність розчину (pН).
5.Утворення малорозчинних речовин.
6.Утворення комплексних сполук.
7.Природа розчинників.
Вплив на окисно-відновні реакції факторів 1-4 є очевидним, оскільки вони безпосередньо присутні у рівнянні Нернста. При цьому роль природи взаємодіючих речовин і їх концентрацій уже розглядалася раніше. Вплив факторів 5-7 здійснюється побічно через зміну співвідношення між активністю (концентрацією) окисненої та відновленої форм.
Роль середовища в окисно-відновних реакціях
Щоб переконатися у впливі кислотності середовища на окисновідновні властивості, запишемо рівняння Нернста для електродних
процесів: |
|
|
|
Mn2+ + 4H2O: |
|
|
|
|
|
|
∙ |
|
||
а) MnO4– +8H+ + 5ē |
|
|
|
|
|
|
|
|||||||
– |
, |
+ |
|
= – |
, |
+ |
5 |
∙ ln |
; |
|||||
б) ClO3 |
+ 6H |
, |
+ 6ē |
= |
, |
+ 6 ∙ ln ∙ ; |
||||||||
|
= Cl +3H2O: |
|
|
|
|
|
|
|
|
|
||||
48

, |
= |
, |
+ 6 ∙ ln |
. |
|||
в) BrO3– + 3H2O + 6ē |
Br– + 6OH–: |
|
|
|
|
|
|
Наведені приклади показують, що збільшення кислотності веде до збільшення значення електродного потенціалу, отже, до зростання окисних властивостей електрохімічної системи. Напроти, зменшення кислотності збільшує відновні властивості електрохімічних систем. Це в першу чергу стосується систем, у яких окиснена і відновлена форма містять різну кількість атомів Оксигену. У тих випадках, коли їх вміст в окисненій і відновленій формах не змінюється, вплив середовища не настільки суттєвий. Останнє відноситься, наприклад, до процесів:
Cl2 + 2ē = 2Cl–; Br2 + 2ē = 2Br–; I2 + 2ē = 2I–.
Для того, щоб з'ясувати, наскільки істотним є вплив кислотності
середовища, порівняємо електродні потенціали напівреакцій а і б для |
|||||||||||||||||
Оскільки |
⁄ |
= 1 моль/л⁄ |
= 1, |
|
|
|
|
|
|
||||||||
pН = 0 і pН = 7 за умови, що |
|
|
⁄. |
|
|
= 1 та |
|
⁄ |
= 1. |
||||||||
1. |
pH = 0, отже, |
, |
|
|
|
, |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
то |
= 1,51 В; |
|
||||||
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|||
|
, |
= |
, |
|
= |
|
|
, |
|
|
|
|
= 1,45 В. |
|
|||
2. |
+ ∙ ln |
∙ |
|
|
|
= 1,51 − 0,67 = 0,84 (В). |
|||||||||||
рН = 7 (нейтральне середовище), значить |
|
= 10 |
моль/л. |
||||||||||||||
|
|
, |
= |
|
|
|
|
|
|
|
|
|
|||||
|
|
5 |
+ 6 |
|
∙ ln ∙ = 1,10 (В). |
||||||||||||
Аналогічно знаходимо |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Видно, що зі зменшенням кислотності зменшується окисна здатність електрохімічної системи. Однак ступінь цієї зміни різна, що призводить в остаточному підсумку до зміни електрорушійних сил окисно-відновних реакцій зі зміною pН і до зміщення хімічної рівноваги або в прямому, або у зворотному напрямку. Розглянемо сказане на прикладі взаємодії:
6Mn2+ + 5ClO4– + 9H2O = 6MnO4– +5Cl– + 18H+. |
||||
1) pH = 0. Оскільки |
, |
< |
, |
(див. вище), то пряма |
реакція за вказаних умов неможлива. Тобто, в кислому середовищі
49

неможливо за стандартних умов окиснити хлорат-йоном Mn2+ до MnО –.
2) рН =4 7.  , , , а значить реакція протікає у
, , , а значить реакція протікає у
прямому напрямку. Таким чином, у нейтральному середовищі з точки зору термодинаміки можна окиснити сполуки Мангану(+2) до перманганат-йону за допомогою хлорат-йону.
Наведені приклади показують, що для здійснення заданої окисновідновної реакції та більш глибокого її протікання необхідна певна кислотність розчину. Вибір середовища (кисле або лужне) можна зробити шляхом порівняння значень стандартної ЕРС реакцій у кислому і лужному середовищах. Оптимальним є те середовище, в якому досягається більше значення ЕРС.
Звернемося до прикладу:
Уякому середовищі (кислому чи лужному) можна здійснити процеси
1.Re + H2O2 → ReО4– + H2O
2.Re + SeO42– → ReO4– + SeO32–
3.Bi(III) + Sn(II) → Bi + Sn(IV)
4.ClO3– + SO32– → Cl– + SO42–?
Розв'язок. Із таблиці додатку необхідно виписати значення стандартних редокс-потенціалів, що характеризують електродні процеси відповідно у кислому та лужному середовищі. Далі розрахувати для кожного середовища ЕРС реакції. Результати розв’язку зведені в загальну таблицю (табл. 3).
Таблиця 3.
Стандартні електродні потенціали та ЕРС
№ |
|
Кисле середовище |
|
|
Лужне середовище |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Рівняння електродного |
E, |
ЕРС, |
Рівняння електродного |
|
E, |
ЕРС, |
|||||
|
|
||||||||||
|
|
процесу |
В |
В |
|
процесу |
|
|
B |
B |
|
|
|
|
|
|
|
|
|
||||
1 |
ReO4–+8H++7ē=Re+4H2O |
0.37 |
1.40 |
ReO4–+4H2O+7ē=Re+8OH– |
|
−0.58 |
1.46 |
||||
H2O2+2H++2ē=2H2O |
1.77 |
|
H2O2+2ē=2OH– |
|
0.88 |
|
|||||
|
ReO4–+8H++7ē=Re+4H2O |
0.37 |
0.78 |
ReO4–+4H2O+7ē=Re+8OH– |
|
-0.58 |
0.63 |
||||
2 |
SeO42– +4H++2ē=H2SeO3 + |
|
|||||||||
1.15 |
SeO42–+H2O+2ē=SeO32–+2OH– |
|
0.05 |
||||||||
|
|
+H2O |
|
|
Bi2O3+3H2O+6ē=2Bi+6OH– |
|
|
|
|||
3 |
BiO++2H++3ē=Bi+H2O |
0.32 |
|
|
-0.46 |
|
|||||
0.17 |
Sn(OH)6 |
+2ē=HSnO2 |
+3OH + |
|
0.47 |
||||||
Sn4++2ē=Sn2+ |
0.15 |
|
-0.93 |
||||||||
|
|
|
|
|
2– |
– |
– |
|
|
|
|
|
|
|
|
|
|
|
+H2O |
|
|
|
|
4 |
ClO3–+6H++6ē=Cl–+3H2O |
1.45 |
|
ClO3–+3H2O+6ē=Cl–+6OH– |
|
0.63 |
|
||||
SO4 |
+4H |
+2ē=H2SO3+ |
1.28 |
|
1.56 |
||||||
0.17 |
SO42–+H2O+2ē=SO32–+2OH– |
|
-0.93 |
||||||||
2– |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
+H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50
З даних таблиці 3 витікає, що реакції 1, 3, 4 краще проводити в лужному середовищі, реакцію 2 – у кислому середовищі.
Вплив утворення малорозчинних речовин на перебіг окисновідновних реакцій
Вплив утворення малорозчинних речовин на глибину протікання окисно-відновних реакцій пов’язане зі зміною співвідношення активностей окисненої та відновленої форм.
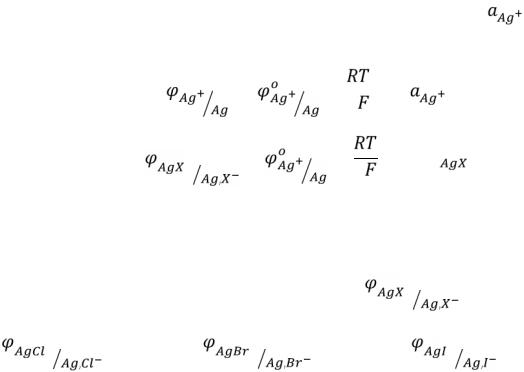
Приклад 1. Розглянемо вплив утворення осадів на процес розчинення срібла.
За відсутності утворення осадів при розчиненні срібла здійснюється електродна реакція:
Ag+ + ē = Agо ϕ° = 0,80 В.
При введенні в розчин галогенід-йонів (Cl–, Br–, I–) утворюються малорозчинні солі. У результаті цього встановлюється рівновага:
AgХ + ē = Agо + X– |
(X = Cl–, Br–, I–). |
У цьому випадку [Ag+] ≠ 1, тобто |
концентрація йонів Аргентуму |
відрізняється від стандартної. Отже, електродний потенціал цього процесу не рівний 0,80 В. Для того, щоб визначити електродний потенціал срібного електроду в присутності галогенід-йонів, необхідно обчислитти активність (концентрацію) йонів Аргентуму. За стандартних умов активність галогенідйонів дорівнює одиниці, тоді активність йонів Аргентуму можна знайти з величини добутку розчинності відповідних галогенідів.
ДРAgX = [Ag+]·[X–], звідки [Ag+] = ДРAgX/[X–]; [X–] = 1 моль/л, тому [Ag+] = ДРAgX. Підставивши відповідні значення [Ag+] ≈ у рівняння
Нернста для срібного електрода, можна розрахувати електродні потенціали |
|||||||
|
|
= |
+ 1 |
∙ ln |
|
; |
|
хлорсрібного, бромсрібного та йодсрібного електродів: |
|
||||||
|
, |
= |
+ |
1 |
∙ ln ДР |
. |
|
ДРAgCl = 1,78×10–10; |
ДРAgBr = 5,3×10–13; |
ДРAgI = 8,3×10–17. |
|||||
В результаті обчислень отримуємо величини |
|
, |
: |
||||
, |
= 0,22 В; |
, |
= 0,08 В; |
|
, = −0,15 В. |
||
51

Утворення осаду приводить до зменшення електродного потенціалу, отже, до збільшення відновних властивостей системи. При цьому відновні властивості металічного срібла збільшуються зі зменшенням розчинності осаду. Так, за відсутності осаду розчинення металічного срібла характеризується досить великим позитивним стандартним електродним потенціалом і, знаходячись у ряді напруг правіше водню, срібло не може розчинятися в розбавлених кислотах-неокисниках з виділенням водню. У присутності йодид-йонів металічнее срібло набуває потенційну можливість витісняти з розчинів кислот водень, тобто поводиться як активний метал (практично ця реакція не відбувається через кінетичний фактор, що пов’язаний із високою енергією активації процесу перетворення металічного срібла в катіон Ag+).
Приклад 2. У табл. 4 наведені дані про вплив утворення осадів на величину електродного потенціалу.
Стандартні електродні потенціали |
Таблиця 4. |
|||
|
|
|||
|
|
|
|
|
Системи без утворення |
Системи з утворенням осаду |
|
||
осадів |
|
|
||
|
|
|
|
|
Електродний процес |
ϕ, В |
Електродний процес |
ϕ, В |
|
Cd2+ + 2ē = Cd |
–0,40 |
CdСO3↓ + 2ē = Cd + CО32– |
–0,74 |
|
Ca2+ + 2ē = Ca |
–2,79 |
Ca(OH)2↓ + 2ē = Ca + 2OH– |
–3,03 |
|
Cu+ + ē = Cu |
0,53 |
CuI↓ + ē = Cu + I– |
–0,19 |
|
Дані цієї таблиці також свідчать про зменшення електродних потенціалів металічних електродів у системах з утворенням осадів.
Чи завжди утворення осадів в окисно-відновній системі приводить до зменшення електродного потенціалу? Щоб відповісти на це запитання, звернемося до прикладу.
Приклад 3. Порівняти вплив малорозчинних осадів на зсув рівноваги електродного процесу в електрохімічних системах:
1. AgI↓ + ē = Ag + I–
2 Cu2+ + I– + ē = CuI↓
Розв'язок. |
= |
+ 1 |
|
∙ ln |
; |
|
|
, |
|
|
|||||
Запишемо рівняння Нернста для наведених електрохімічних систем: |
|||||||
, |
|
|
|
|
∙ ln |
|
. |
|
|
|
|
|
|||
52

|
|
|
= ДРAgI |
= 1 |
|
л ; |
С |
|
= 1 л |
|
|
CuI |
|
|
|
|
|
|||
За стандартних умов |
– |
= |
моль |
+ |
|
|
|
моль і тому |
|
|
|
|
|
|||||||
|
|
|
, |
|
|
|
|
|
ДР |
|
≈ −0,15 В; |
|
|
|
|
|||||
|
|
|
|
8,3·10–17; |
|
|
|
= |
|
ДР |
|
= 1,1·10–12. |
|
|
|
|||||
|
|
о |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
−0,15 В |
|
, |
о |
|
|
|
|
|
|
|
∙ ln ДР |
≈ 0,88 В; |
о |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Отже, |
стандартний електродний |
потенціал |
системи 1 |
|
|
|
|||||||||||||
|
|
порівнянні зі стандартним електродним потенціалом |
відповідної |
|||||||||||||||||
|
|
|
⁄ |
, |
= |
|||||||||||||||
системи без осаду |
|
|
|
|
|
|
зменшується. І навпаки, у системі 2 |
|||||||||||||
спостерігається |
збільшення |
стандартного |
|
електродного |
потенціалу |
|||||||||||||||
|
|
⁄ |
|
= 0,8 В |
|
|
|
|
|
|
|
|
|
|
|
|||||
о |
⁄ |
= 0,16 В . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, ⁄ |
= 0,88 В |
|
порівнянні |
|
з потенціалом системи |
без |
осаду |
|||||||||||||
Це пов'язане з тим, що у випадку 1 малорозчинна сполука утворюється на базі окисненої (Ag+) форми, у другому випадку – на базі відновленої форми (Cu+). Таким чином, зменшення активності окисненої і відновленої форм по-різному позначається на електродному потенціалі (за рівнянням Нернста).
Отже, утворення осаду окисненою формою електродної реакції приводить до збільшення відновних властивостей електрохімічної системи. Утворення осаду відновленою формою електродної реакції посилює окисні властивості системи.
Вплив комплексоутворення на протікання окисно-відновних реакцій
Вплив комплексоутворення на протікання окисно-відновних реакцій аналогічний впливу утворення малорозчинних речовин. У результаті утворення комплексних сполук співвідношення активностей окисненої і відновленої форм суттєво змінюється. На відміну від осадоутворення
комплексоутворення практично завжди призводить до зменшення електродного потенціалу у порівнянні з відповідною системою без комплексоутворення. Це пов'язане з тим, що комплекс утворюється або тільки на основі окисненої форми, або, у випадку утворення комплексу обома формами, комплекс на базі окисненної форми більш стійкий. У результаті спостерігається зменшення активності окисненої форми у порівнянні з відновленою, і електродний потенціал такої системи знижується в порівнянні із системою без комплексоутворення. Розрахунки стандартних електродних потенціалів електрохімічних систем із комплексоутворенням, використовуючи дані про стандартні електродні
53
потенціали відповідних систем без комплексоутворення, можна здійснити способом, розглянутим у попередньому розділі у випадку систем з осадами. При цьому необхідно використовувати дані про константи стійкості комплексів. Однак для практичних цілей можна користуватися таблицею стандартних електродних потенціалів, у якій наводяться дані і про системи з комплексоутворенням.
Розглянемо вплив комплексоутворення, порівнюючи електродні потенціали систем, наведені в табл. 5. Ознайомившись із даними таблиці 3, можна переконатися у справедливості висловленого твердження про зменшення електродного потенціалу електрохімічних систем з комплексоутворенням. Крім того, можна бачити, що посилення відновних властивостей систем збільшується зі збільшенням стійкості комплексних сполук. Особливо зупинимося на дуже виразних прикладах, наведених у таблиці.
Таблиця 5
Вплив комплексоутворення на електродний потенціал електрохімічних систем
Системи без |
|
|
Системи із утворенням комплексів |
|
||
комплексоутворення |
|
|
||||
|
|
|
|
|||
Рівняння |
|
|
|
|
|
|
електродного |
|
ϕ°, В |
№ |
Рівняння електродного |
pКутв. |
ϕ°, В |
процесу |
|
|
|
процесу |
|
|
|
|
|
|
|
|
|
Hg2++2ē = Hgо |
|
0,85 |
1 |
[HgCl4]2– + 2ē = Hg + 4Cl– |
15 |
0,48 |
|
|
|
2 |
[HgBr4]2– + 2ē = Hg + 4Br– |
21 |
0,21 |
|
|
|
3 |
[HgI4]2– + 2ē = Hg + 4I– |
30 |
-0,04 |
|
|
|
4 |
[Hg(CN)4]2–+2ē = Hg+4CN– |
39 |
-0,37 |
Zn2++2ē=Zno |
|
- 0,75 |
5 |
[Zn(NH3)4]2++2ē = Zn + 4NH3 |
9 |
-1,04 |
|
|
|
6 |
[Zn(CN)4]2–+2ē =Hg+CN– |
20 |
-1,26 |
Au+ + ē = Auо |
|
1,68 |
7 |
[Au(CN)2]– + ē = Au + 2CN– |
20 |
-0,61 |
Au3+ + 3ē = Auо |
|
1,50 |
8 |
[AuСl4]– + 3ē = Au + 4Cl– |
21 |
1,00 |
Co3+ + ē = Co2+ |
|
1,95 |
9 |
[Co(CN)6]3–+ ē = [Co(CN)6]4– |
64 (для |
-0,83 |
|
|
|
|
|
[Co(CN)6]3–); |
|
|
|
|
|
|
19 (для |
|
|
|
|
|
|
[Co(CN)6]4–) |
|
Fe3+ + ē = Fe2+ |
|
0.77 |
10 |
[Fe(CN)6]3– + ē = [Fe(CN)6]4– |
44 (для |
0,36 |
|
|
|
|
|
[Fe(CN)6]3–) |
|
|
|
|
|
|
37 (для |
|
|
|
|
|
|
[Fe(CN)6]4–) |
|
Відомо, що золото внаслідок малої активності є типовим представником благородних металів, характеризуючись при цьому за
54
