
- •Передмова
- •Класифікація електродів
- •Можливість гідролізу
- •Прогнозування конпропорціонування (конмутації)
- •Передбачення явищ дисмутації
- •Витіснення водню
- •Окиснення киснем повітря
- •Виділення кисню
- •Окисно-відновні реакції між сполуками одного елементу
- •Обмеження застосування діаграми Пурбе
- •Роль середовища в окисно-відновних реакціях
- •Вплив природи розчинника на окисно-відновні реакції
- •Роль кінетичного фактора в окисно-відновних реакціях

важливе значення діаграми Пурбе мають у прогнозуванні корозії в різних умовах.
ЗастосуваннядіаграмамПурбе
Можливість гідролізу
Якщо при якомусь значенні рН існує гідроксид деякого елементу, це значить, що вільний йон (зокрема, йон металу) при цьому значенні рН буде гідролізуватися.
Приклад 1. На діаграмі Пурбе для Феруму (рис. 8) при рН>4 стійкий Fe(OH)3, а катіон Fe3+ нестійкий. Це значить що при pН > 4 йон Fe3+ буде повністю гідролізуватися:
Fe3+ + 3H2O = Fe(OH)3 + 3H+
Гідроліз йону Fe3+ йде при рН > 4 і залежить від його концентрації («розмита» границя).
Рисунок 8. Діаграма Пурбе для сполук Феруму у водному розчині
41
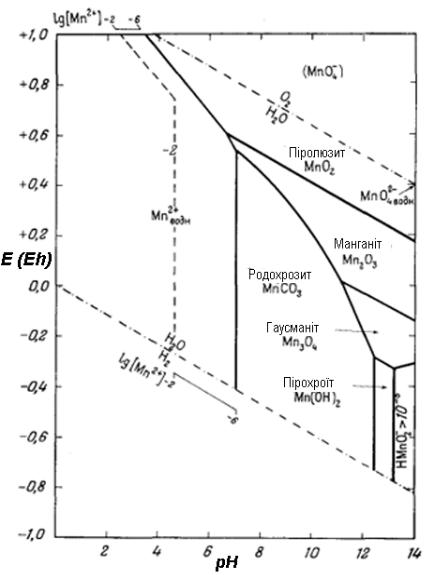
Прогнозування конпропорціонування (конмутації)
Якщо при даному значенні рН дві форми розділені третьої, то ці дві форми будуть конпропорціонувати з утворенням третьої.
Приклад 1. На діаграмі Пурбе для Мангану (рис. 9) при рН 0÷3 Mn2+ і MnО4– розділені полем MnО2. А це значить, що Mn2+ і MnО4– будуть конпропорціонувати:
3Mn2+ + 2MnО4– + 2H2O = 5MnО2 + 4H+
Рисунок 9. Діаграма переважних форм (діаграма Пурбе) для Мангану
Приклад 2. На діаграмі Пурбе для Мангану при рН 4÷7 Mn2+ і MnО4– розділені двома формами (MnО2, Mn2O3). Це значить, що Mn2+ і MnО4–
42
будуть зазнавати конмутації. При цьому можливі два продукти, причому переважний продукт залежить від співвідношення реагентів або взаємної швидкості двох конкуруючих реакцій:
3Mn2+ + 2MnО4– + 2H2O = 5MnО2 + 4H+ 8Mn2+ + 2MnО4– + 7H2O = 5Mn2O3 + 14H+
Приклад 3. На діаграмі Пурбе для Мангану в діапазоні рН 0÷14 між MnО2 і MnО4– проміжних форм немає. А значить, що у цьому діапазоні рН MnО2 і MnО4– конпропорціонувати не будуть.
Передбачення явищ дисмутації
Якщо форма в даному ступені окиснення при заданому рН на діаграмі Пурбе відсутня, то вона буде диспропорціонувати на сусідні форми, наявні на діаграмі Пурбе.
Приклад 1. На діаграмі Пурбе для Мангану при рH<14 відсутній манганат MnO42- (ступінь окиснення Мангану +6). Це значить, що за такого рН манганат буде диспропорціонувати. Найближчий стійкий ступінь окиснення знизу +4 (MnО2), зверху – +7 (MnО4–). Саме ці форми і будуть утворюватися при диспропорціонуванні:
3MnО42– + 2H2O = MnО2 + 2MnО4– + 4OH–.
Цей процес, зокрема, буде відбуватися при розчиненні твердого манганату у воді або при підкисленні сильнолужного розчину, у якому манганат стійкий.
Приклад 2. На діаграмі Пурбе для Мангану сполуки Мангану(+3) відсутні зовсім. Це значить, що при розчиненні у воді сполук Мангану(+3) вони будуть диспропрціонувати на найближчі стійкі ступені окиснення +2 знизу (у вигляді Mn2+) і +4 зверху (у вигляді MnО2):
2Mn3+ + 2H2O = Mn2+ + MnО2 + 4H+.
Витіснення водню
Якщо область існування даної форми лежить нижче області стійкості води, то дана форма при відповідних рН здатна реагувати з водою, витісняючи водень.
Реально внаслідок кінетичних проблем (тобто малої швидкості подібних реакцій) виникає т.з. ефект перенапруги виділення водню, і для реального його виділення відповідна форма повинна лежати нижче області стійкості води як мінімум на 0,4÷0,8 В.
43
Окрім цього, гідроксиди металів, як правило, пасивують метал, тому в нейтральних і лужних середовищах водень, як правило, не виділяється, навіть якщо область існування металу лежить значно нижче області стійкості води.
Приклад. На діаграмі Пурбе для Мангану область його існування знаходиться помітно нижче нижньої границі стійкості води. Виходить, він здатний витісняти водень:
Mn + 2H+ = Mn2+ + H2.
Це відповідає тому факту, що метал у ряді активності розміщений зліва від водню.
Окиснення киснем повітря
Якщо область існування якоїсь форми лежить помітно нижче верхньої границі стійкості води, то ця форма може бути окиснена киснем повітря. При цьому утворюється форма, яку перетинає верхня границя стійкості води.
Приклад 1. На діаграмі Пурбе для Мангану область існування Mn(OH)2 лежить суттєво нижче верхньої границі стійкості води. Це значить, що він може бути окиснений до Mn3O4, Mn2O3 і, зрештою, до MnО2 (але не MnО4–, тому що ця форма лежить вище області існування води):
2Mn(OH)2 + O2 = 2MnО2 + 2H2O
І дійсно, Mn(OH)2 на повітрі дуже швидко набуває коричневого забарвлення, характерного для MnO2.
Приклад 2. На діаграмі Пурбе для Феруму область існування металічного заліза лежить набагато нижче верхньої межі існування води. Це значить, що залізо буде окиснюватися киснем до Fe(OH)3, що й спостерігається в процесі ржавіння сталей. При цьому, оскільки процес пролонгований у часі, утворюються дегідратовані форми (Fe3O4, Fe2O3 і ін.), які більш стійкі термодинамічно, але утворюються повільно.
Виділення кисню
Якщо поле якоїсь форми повністю лежить вище області існування води, вона може розкладати з виділенням кисню.
Приклад. На діаграмі Пурбе для Феруму область існування фератів FeО42– лежить набагато вище області існування води (особливо в кислому середовищі). Тому при підкисленні ферати розкладаються із виділенням кисню:
44
