
- •Передмова
- •Класифікація електродів
- •Можливість гідролізу
- •Прогнозування конпропорціонування (конмутації)
- •Передбачення явищ дисмутації
- •Витіснення водню
- •Окиснення киснем повітря
- •Виділення кисню
- •Окисно-відновні реакції між сполуками одного елементу
- •Обмеження застосування діаграми Пурбе
- •Роль середовища в окисно-відновних реакціях
- •Вплив природи розчинника на окисно-відновні реакції
- •Роль кінетичного фактора в окисно-відновних реакціях

Міністерство освіти і науки, молоді та спорту України
Сумський державний педагогічний університет ім. А.С.Макаренка
Кафедра хімії та методики навчання хімії
Окисно-відновніУкладач Касьяненко Г.Я.
системи
Розглянуті основніпоняття тазакономірності перебігу окисно-відновних реакцій; елементиелектрохімії,що використовуються длякількісноїоцінкипротікання окисно-відновнихреакцій; формипрактичного застосування стандартнихелектроднихпотенціалів. Обговорюєтьсявплив різних факторів на рівновагив окисно-відновних системах.
Суми
СумДПУ 2012
ЗМІСТ |
|
Передмова.............................................................................................................................................. |
4 |
Загальніпоняттяі методидобору коефіцієнтіввокисно-відновних реакціях................................. |
5 |
Електродніпотенціали.Гальванічнийелемент ................................................................................ |
12 |
Класифікаціяелектродів..................................................................................................................... |
17 |
Порівняльнаоцінкаокисно-відновних властивостейречовин і визначення можливості |
|
здійсненняокисно-відновних реакцій............................................................................................... |
21 |
Залежність електродного потенціалу відконцентрації. Рівняння Нернста.................................... |
26 |
Діаграми Латимера.............................................................................................................................. |
28 |
Діаграмиокисних станів (діаграми Фроста)...................................................................................... |
32 |
Залежність Евід рН.............................................................................................................................. |
36 |
Стійкість речовину водному розчині................................................................................................. |
38 |
Діаграми Пурбе (Е – рН-діаграми)...................................................................................................... |
40 |
ЗастосуваннядіаграмамПурбе.......................................................................................................... |
41 |
Можливість гідролізу....................................................................................................................... |
41 |
Прогнозуванняконпропорціонування (конмутації)..................................................................... |
42 |
Передбачення явищдисмутації ..................................................................................................... |
43 |
Витісненняводню............................................................................................................................ |
43 |
Окисненнякиснемповітря.............................................................................................................. |
44 |
Виділеннякисню.............................................................................................................................. |
44 |
Окисно-відновні реакції між сполукамиодного елементу.......................................................... |
45 |
Обмеження застосуваннядіаграми Пурбе.................................................................................... |
45 |
Константахімічноїрівновагиокисно-відновної реакції................................................................... |
46 |
Фактори,що визначаютьнапрямок іглибинупротікання окисно-відновнихпроцесів................ |
48 |
Роль середовища вокисно-відновних реакціях ........................................................................... |
48 |
Впливутворення малорозчинних речовин наперебіг окисно-відновнихреакцій.................... |
51 |
Впливкомплексоутворення на протіканняокисно-відновнихреакцій...................................... |
53 |
Впливприроди розчинника наокисно-відновні реакції.............................................................. |
55 |
Роль кінетичного факторав окисно-відновнихреакціях.............................................................. |
56 |
Бібліографічний список....................................................................................................................... |
58 |
Стандартніокисно-відновні потенціалиу воднихрозчинах............................................................ |
59 |
3
Передмова
Серед різноманітних процесів і явищ, що протікають у навколишньому світі, важливе місце займають окисно-відновні реакції. Зокрема, такі життєво важливі процеси, як дихання та фотосинтез включають стадії окиснення і відновлення. Процеси спалювання забезпечують основну частину енергоспоживання людства та роботу транспорту. Хімічна енергетика, металургія, різноманітні процеси хімічної промисловості, включаючи електроліз – от неповний перелік тих областей, де окисно-відновні реакції (ОВР) відіграють ключову роль.
Без вивчення особливостей окисно-відновних реакцій як окисновідновної системи окисник–відновник, неможливо зрозуміти сучасну хімію. Цей навчально-методичний посібник має допомогти студентам в освоєнні основних положень теорії ОВР і набутті навичок розв'язку різноманітних задач та завдань за їх участю починаючи від зрівнювання ОВР, розрахунків стандартних окисно-відновних потенціалів, і закінчуючи комбінованими завданнями, у яких необхідно враховувати вплив на редокс-системи таких факторів, як природа реакційного середовища, pН розчину, наявність комплексоутворення чи утворення нерозчинних сполук та ін.
На сьогодні широко застосовуються графічні способи представлення хімії окисно-відновних станів елемента. Це діаграми Латимера, діаграми Фроста та діаграми Пурбе (E – pН). У збірнику представлені основні способи їх побудови, наведені приклади використання.
До посібника включено багато прикладів та завдань із розв’язками, які допоможуть глибше зрозуміти сутність матеріалу.
4
Загальніпоняттяіметодидоборукоефіцієнтівв окисно-відновнихреакціях
Окисно-відновними реакціями називаються такі реакції, які протікають зі зміною ступеня окиснення атомів елементів реагуючих речовин, що входять до їх складу.
Для характеристики стану атома в молекулі або йоні користуються поняттям «ступінь окиснення». Ступенем окиснення називають умовний електричний заряд, якого набув би даний атом за умови, що кожна спільна пара електронів, яка зв'язує його з іншим атомом, повністю перейшла б до більш електронегативного атома. Це той умовний заряд атома, який обчислюють, виходячи із припущення, що молекула або молекулярний йон складаються тільки з одноатомних йонів. Для визначення ступеню окиснення атома в хімічній сполуці використовують наступні умовні допущення:
-Гідроген у всіх сполуках (крім гідридів металів) має ступінь окиснення +1;
-Оксиген у всіх сполуках (окрім пероксосполук, озонідів та сполук з Флуором) має ступінь окиснення –2;
-ступінь окиснення атомів у простих речовинах дорівнює нулю.
При окисно-відновних реакціях протікають два взаємопов’язаних процеси: окиснення і відновлення. Один пов'язаний з віддачею електронів атомами або йонами, а інший – із приєднанням електронів.
Окисниками називаються речовини, атоми або йони яких приймають електрони. Очевидно, що тільки окисними властивостями володіють речовини, які містять у своєму складі атоми, що знаходяться у найвищому ступені окиснення (вони здатні тільки знижувати свій ступінь окиснення). Окисні властивості можуть проявляти і речовини, що містять атоми в проміжному ступені окиснення, або прості речовини – неметали. Так, до типових і часто використовуваних у практиці окисників відносяться кисень і галогени у вигляді простих речовин, нітратна кислота, царська водка, концентрована сульфатна кислота, Калій дихромат, Калій хлорат (бертолетова сіль), Калій перманганат, пероксодисульфат амонію і деякі інші.
Відновниками називаються речовини, атоми або йони яких віддають електрони. Очевидно, що тільки відновні властивості мають речовини, які містять у своєму складі атоми, що перебувають у найнижчому ступені окиснення (вони здатні тільки підвищувати свій ступінь окиснення). Відновниками можуть бути і речовини, що містять атоми в проміжному ступені окиснення, або прості речовини – метали і неметали. Типовими і часто вживаними у практиці відновниками є багато металів у вигляді простих речовин (Na, K, Ca, Mg, Al, Zn), такі неметали, як вуглець, бор, кремній, водень у вигляді простих речовин, а також сірководень, йодидна кислота і її солі, солі Стануму (II) і Феруму (II) та деякі інші.
5
Окисно-відновні реакції можна розділити на три групи:
- реакції міжатомного і міжмолекулярного окиснення-відновлення, у яких окисник і відновник є різними речовинами, наприклад:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O;
- реакції диспропорціонування, у яких молекули або атоми однієї речовини реагують один з одним як відновник і окисник. У цьому випадку атоми елемента перебувають у проміжному ступені окиснення, внаслідок чого можуть одночасно підвищувати і знижувати його. Наприклад:
Cl2 + H2O = HСl + HСlО;
- реакції внутрішньомолекулярного окиснення-відновлення, у яких ступінь окиснення змінюється в різних атомів, які входять до складу однієї й тієї ж молекули чи речовини, наприклад:
2KСlО3 = 2KСl + 3O2 .
Для складання рівняння реакції (добору коефіцієнтів) використовують 2 способи: електронного балансу та йонно-електронних схем. Метод електронного балансу застосовується при доборі коефіцієнтів в окисновідновних реакціях, що протікають при сплавленні або термічному розкладанні речовин, при випаленні – взаємодії твердої речовини з газоподібною, при взаємодії металів із практично безводними кислотами.
Метод йонно-електронних схем (метод напіреакцій) використовують при знаходженні коефіцієнтів в окисно-відновних реакціях, що відбуваються у водних розчинах, причому це можуть бути кислі або лужні розчини, чи розчини, близькі до нейтральних. У методі електронного балансу складають допоміжні електронні рівняння. Докладно зупинимося на методиці добору коефіцієнтів в окисно-відновних реакціях за допомогою йонно-електронних схем (метод напівреакцій). За цим методом спочатку складають допоміжні йонно-електронні рівняння. Слід розрізняти методику зрівнювання в кислому та лужному середовищі. При складанні рівняння реакції, вихідні речовини і передбачувані продукти в якій не містять сполук з яскраво вираженим кислотним або основним характером, вважають, що характер середовища близький до нейтрального. У цьому випадку рекомендується зрівнювати за схемою для слабколужного (лужного) середовища, хоча зустрічаються й виключення. При використанні йонноелектронного методу слід враховувати, що при складанні напівреакцій, які відповідають окремо процесу відновлення та процесу окиснення, атоми елементів, що змінюють свій ступінь окиснення, записують у формі тих частинок, які реально присутні у водних розчинах. Це означає, що сильні електроліти (солі, сильні кислоти і основи) записують у вигляді йонів, неелектроліти (у т.ч. більшість органічних речовин), слабкі електроліти (наприклад, сульфідна, гіпохлоритна, карбонатна кислоти, гідрогенпероксид тощо), газуваті речовини (наприклад, SO2, NO, CO, Cl2, O2, H2) записують у вигляді молекул, а малорозчинні речовини – осади
(наприклад, MnО2, PbО2, PbО, I2, Cr(OH)3, CuS, PbCl2) – у вигляді
6
електронейтральних формульних одиниць, тобто в молекулярному вигляді. Розглянемо формальні правила йонно-електронного методу для
зрівнювання на прикладі реакції взаємодії Калій перманганату із Калій сульфітом в кислому і лужному середовищах (у нейтральному середовищі ця реакція зрівнюється як і в лужному).
Кисле середовище
1. Визначаємо склад продуктів. Щоб зробити висновок про те, яка із реагуючих речовин буде окисникем, а яка – відновником, а також які речовини будуть утворюватися в ході реакції, побудуємо схеми можливих ступенів окиснення для атомів обох елементів, що їх змінюють (у нашому випадку для Mn і S). Відомо, що вищий ступінь окиснення елемента, як правило, дорівнює номеру групи (N), у якій він знаходиться. Нижчий ступінь окиснення для металів – це нуль, а для неметалів – це негативний ступінь окиснення, який визначається числом електронів, яких бракує для досягнення конфігурації атома інертного газу, тобто чисельно дорівнює 8 – N.
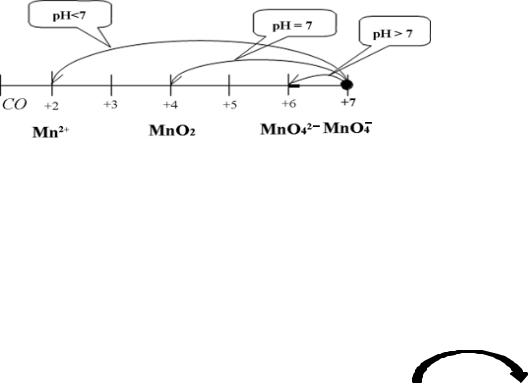
У перманганат-йоні MnO4– атом Мангану перебуває у найвищому ступені окиснення +7, тому він може проявляти тільки окисні властивості.
Укислому середовищі відновлюється до cолей Мангану(+2) (схема 1).
Усульфіт-йоні атом Сульфуру перебуває в проміжному ступені окиснення +4, тому може проявляти двояку функцію: і відновну, і
Схема 1. Окисно-відновні перетворення |
окиснювальну. |
Але |
||
оскільки |
партнер по |
|||
сполук Мангану |
||||
реакції |
– |
Калій |
||
|
||||
|
перманганат – |
може |
||
проявляти тільки окиснювальні властивості, то Калій сульфіт буде проявляти протилежну функцію – відновну. Єдиний можливий ступінь окиснення, у який може перейти S(+4), віддаючи електрони (схема 2), це S(+6) у формі сульфат-йону SO42–.
Ступені окиснення (СО) Сульфуру
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–2 |
0 |
|
+2 |
+4 |
+6 |
|||||
H2S |
S |
SCl2 |
SO2 |
SO3 |
||||||
S2– |
SO32– |
SO42– |
||||||||
|
|
|
|
|||||||
Схема 2. Окисно-відновні перетворення сполук Сульфуру
7
2. Спочатку складемо схему напівреакції
MnO4– |
→ Mn2+. |
Необхідно зрівняти число атомів усіх елементів у лівій і правій частинах, враховуючи, що при зрівнюванні в кислому середовищі до йонних схем можна включати тільки катіони Гідрогену Н+ (протони) і молекули води Н2О.
Слід дотримуватися наступної послідовності дій:
а) зрівняти число атомів, що змінюють ступінь окиснення. У наведеному прикладі число атомів Mn в обох частинах напівреакції однакове;
б) зрівняти число атомів Оксигену додаванням молекул Н2О до тієї частини напівреакції, де не вистачає цих атомів, або вони відсутні зовсім. У нашому прикладі слід додати до правої частини напівреакції 4 молекули Н2О:
MnO4– |
→ Mn2+ + 4H2O; |
в) атоми Гідрогену, що з'явилися в правій частині, зрівняти додаванням до лівої частини відповідної кількості катіонів Н+:
MnO4– + 8Н+ |
→ Mn2+ + 4H2O |
Число атомів кожного елемента в обох частинах рівняння стало однаковим; г) зрівняти алгебраїчну суму зарядів частинок у лівій і правій частині додаванням або вирахуванням з лівої частини необхідного числа електронів. У правій частині розглянутої напівреакції сумарний заряд рівний +2, а в лівій він рівний +7. Для того, щоб суми зарядів частинок стали в обох частинах однаковими, треба до лівої додати 5 негативних зарядів, тобто 5 електронів. В результаті одержимо йонно-електронне
рівняння:
MnO4– + 8Н+ + 5ē → Mn2+ + 4H2O
2. Складемо схему другої напівреакції |
|
||
SO32– |
|
|
SO42–; |
а) число атомів Сульфуру в обох |
частинах напівреакції однакове; |
||
|
→ |
|
|
б) зрівняємо число атомів Оксигену додаванням однієї молекули води |
|||
до лівої частини |
|
|
|
SO32– + Н2О |
|
|
SO42–; |
|
|
додаванням двох катіонів Н+ |
|
в) зрівняємо число атомів Гідрогену → |
|
||
до правої частини |
|
|
|
SO32– + Н2О |
|
SO42– + 2Н+; |
|
|
сумарний заряд частинок дорівнює |
||
г) враховуючи, що в лівій частині→ |
|
|
|
–2, а в правій він нульовий, то вираховуємо з лівої частини два електрони
8
SO32– + Н2О – 2ē → SO42– + 2Н+.
Склавши дві йонно-електронні схеми, знаходимо коефіцієнти, на які слід помножити число частинок кожної з напівреакцій, і записуємо сумарне скорочене йонно-електронне рівняння:
MnO4– + 8Н+ + 5ē → Mn2+ + 4H2O |
×2 |
SO32– + Н2О – 2ē SO42– + 2Н+ |
×5 |
|
|
2MnO4– + 16Н+ + 5SO32– + 5Н2О = 2Mn2+ + 8H2O + 5SO42– + 10Н+
Скорочуємо однакові частинки у лівій і правій частині рівняння: 2MnO4– + 6Н+ + 5SO32– = 2Mn2+ + 3H2O + 5SO42–.
Складаємо молекулярне рівняння реакції:
2KMnO4 +5K2SO3 +3H2SO4 = 2MnSO4+6K2SO4 +3Н2 О
Лужне середовище
У лужному середовищі MnО4– відновлюється до похідних Mn(VI) в формі манганат-йону MnО42–. Сульфіт-йон окисниться до сульфат-йону
(схеми 1, 2).
При зрівнюванні рівнянь реакцій, що протікають у лужному середовищі до йонних схем можна включати тільки гідроксид-йони та молекули води.
1. Складемо схему першої напівреакції. Слід дотримуватися такої послідовності дій:
а) зрівняти число атомів, що змінюють ступінь окиснення. У
наведеному прикладі число атомів Сульфуру в обох частинах напівреакції |
|
||
однакове; |
SO32– |
→ SO42– |
– |
б) зрівняти число атомів Оксигену додаванням гідроксид-аніонів ОН до тієї частини, у якій є нестача атомів Оксигену або вони відсутні взагалі, причому число доданих ОН– повинне перевищувати в 2 рази число відсутніх атомів Оксигену. У нашому прикладі слід додати до лівої частини напівреакції два гідроксид-йони:
SO32– + 2ОН– |
|
|
SO42– |
в) атоми Гідрогену, що з'явилися в лівій частині, зрівняти додаванням |
|||
|
|
→ |
|
до правої частини необхідної кількості молекул Н2О: |
|||
SO32– + 2ОН– |
|
SO42– + Н2О. |
|
Число атомів кожного елемента в |
обох частинах напівреакції стало |
||
→ |
|
|
|
однаковим; г) зрівняти алгебраїчну суму зарядів частинок у лівій і правій частині
додаванням до лівої або вирахуванням з неї необхідного числа електронів. У правій частині розглянутої напівреакції сумарний заряд рівний –2, а в лівій він становить –4. Для того, щоб суми зарядів частинок
9
стали в обох частинах однаковими, віднімаємо з лівої два негативних
заряди, тобто 2 електрона, і одержуємо йонно→ -електронну напівреакцію: SO32– + 2ОН– – 2ē SO42– + Н2О.
2. Складемо схему другої напівреакції відновлення перманганат-йону до манганат-йону.
У даному конкретному прикладі процедура спрощується, тому що
число всіх атомів і в лівій, і в правій частині напівреакції MnO4– → MnO42–
однакове. Тому досить зрівняти алгебраїчну суму зарядів частинок у лівій
і правій частинах і одержуємо другу йонно-електронну напівреакцію: MnO4– + ē → MnO42–.
Склавши обидві йонно-електронні схеми, знаходимо коефіцієнти, на які слід помножити число частинок першої і другої напівреакцій, і записуємо сумарне йонно-електронне рівняння
SO32– + 2ОН– – 2ē SO42– + Н2О |
×1 |
MnO4– + ē → MnO42– |
×2 |
|
|
SO32– + 2ОН– + 2MnO4– = SO42– + Н2О + 2MnO42–
Або у заключному вигляді:
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + Н2О.
Метод йонно-електронних схем дозволяє легко зрівнювати і окисновідновні реакції за участю органічних речовин. Розставимо, для прикладу, коефіцієнти в рівнянні окиснення бутена-2 Калій перманганатом в кислому середовищі:
C4H8 + KMnO4 + H2SO4 = CH3COOH + … Запишемо напівреакції окиснення та відновлення:
C4H8 + 4H2O – 8e → 2CH3COOH + 8H+ MnO4– + 8Н+ + 5ē → Mn2+ + 4H2O.
Збалансувавши кількість електронів, що віддаються та приймаються та здійснивши відповідні скорочення, запишемо йонно-електронне рівняння:
5C4H8 + 8MnO4– + 24Н+→ 10CH3COOH + 8Mn2+ + 12H2O, або в молекулярній формі:
5C4H8 + 8KMnO4 + 12Н2SO4 = 10CH3COOH + 8MnSO4 + 4K2SO4 + 12H2O.
Навіть дуже складні на перший погляд реакції можуть бути легко зрівняні йонно-електронним методом. Нехай необхідно визначити продукти реакції і розставити коефіцієнти в нижчеподаному рівнянні за умови, що всі елементи-відновники окиснюються до найвищого можливого ступеня
10
окиснення:
[Cr{CO(NH2)2}6]4[Cr(CN)6]3 + KMnO4 + HNO3 → … .
Запишемо напівреакції окиснення йонів [Cr{CO(NH2)2}6]3+ і [Cr(CN)6]4-: 2[Cr{CO(NH2)2}6]3+ + 91H2O – 198ē → Cr2O72– + 12CO2 + 24NO3– + 230Н+;
2[Cr(CN)6]4– + 67H2O– 128ē → Cr2O72– + 12CO2 + 12NO3– + 134H+ .
Для спрощення подальших викладень, враховуючи стехіометрію комплексу-відновника у вихідному рівнянні, помножимо першу напівреакцію на 4, а другу – на 3 і складемо отримані рівняння. Таким чином, одержуємо сумарну напівреакцію окиснення:
8[Cr{CO(NH2)2}6]3+ + 6[Cr(CN)6]4– + 565H2O – 1176ē =
= 7Cr2O72– + 84CO2 + 132NO3– + 1322H+.
Напівреакція відновлення має вигляд:
MnO4– + 8Н+ + 5ē → Mn2+ + 4H2O.
Збалансувавши кількість відданих та прийнятих електронів і провівши відповідні скорочення, одержимо:
40[Cr{CO(NH2)2}6]3+ + 30[Cr(CN)6]4– + 1176MnO4– +2798Н+ =
= 35Cr2O72– + 1176Mn2+ + 420CO2 + 660NO3– + 1879H2O
або остаточно:
10[Cr{CO(NH2)2}6]4[Cr(CN)6]3 + 1176KMnO4 + 2798HNO3 = 35K2Cr2O7 + + 420CO2 + 1106KNO3 + 1176Mn(NO3)2 + 1879H2O.
Наведена реакція цікава тим, що значення цілого ряду коефіцієнтів у рівнянні становлять кілька тисяч(!). Тому знайти стехіометричні коефіцієнти в рівнянні простим добором або методом електронного балансу надзвичайно важко.
Запитання і завдання для самостійного виконання
Визначте продукти і розставте стехіометричні коефіцієнти в рівняннях
наступних реакцій: |
|
|
|
|
|
→ |
|
|
|
|
|
|
|
||
1. K2Cr2O7 + KI + H2SO4 |
|
|
19. P + HNO3 |
|
|
|
|
|
|
|
|||||
2. PbO2 + FeSO4 + H2SO4→ |
20. P + КOН |
|
|
|
|
|
|
|
|
||||||
4 |
2 |
|
|
|
4 |
|
P + H2SO4 |
|
|
|
|
||||
3. КMnO + SnCl + KOH→ |
21. KMnO +→ |
2 |
7 |
KOH |
|
||||||||||
4 |
2 |
|
→ |
2 |
2 |
2 |
|
||||||||
4. КMnO + SnCl + HCl |
|
22. H О + K Cr O + |
|
→ |
|
→ |
|||||||||
5. H2S + KMnO4 → |
→ |
23. H3PO2 + CuSO4 + H2O |
|
||||||||||||
6. H2O2 + FeSO4 + H2SO4 |
4 → |
24. KClO + Na2S → |
|
|
|
→ |
|||||||||
4 |
|
2 |
25. Na2SO3 + K2Cr2O7 + KOH → |
||||||||||||
7. KClO + FeSO + H SO→ |
|
|
|
|
|
→ |
|
|
|
|
|
||||
8. H2O2 + P → |
|
|
|
|
26. Cl2 + I2 + H2O |
|
|
|
|
|
|||||
9. KI + KNO2 → |
|
|
|
→ |
27. H2TeO3 + H2S |
|
|
→ |
|
||||||
10. H SO + H O |
|
|
|
28. Na S O + Cl |
|
|
|
||||||||
2 3 2 2 |
|
|
|
|
2 2 3 |
|
|
2 |
+ H2O |
|
|
|
|
||
4 + H2SO4 |
|
29. NaNO2 + FeCl2 + HCl |
|
|
|
||||||||||
11. NO + KMnO |
|
→ |
|
|
|
|
|
|
|
|
|
→ |
|
||
11
12. KOH + O3 |
|
|
|
||
2 |
HCl |
|
|
||
13. MnO + |
|
|
→ |
|
|
2 |
+ |
HCl |
|
||
14. CaOCl |
|
|
→ |
|
|
15. KClO + H C → |
|
||||
3 |
|
|
2 |
2O4 |
|
2 2 |
2 7 |
2SO4 |
|
||
16. I + K Cr O + H → |
|
||||
17. N2H4 + FeCl3 + NaOH→ |
|||||
18. Au + HCl + HNO3 → |
→ |
||||
30. Si + NaOH →
31. HI + H2SO4
32. MnO2 + KBr + H2SO4
→ →
33. Cl2 + H2O
34. Fe2(SO4)3 + SO2 |
|
→ |
|
35. NH2OH + FeSO4 + H2SO4 |
|
|
→ |
36. H3PO3 + HgCl2 + H2O → → |
|
Електродніпотенціали.Гальванічнийелемент
Для характеристики окисно-відновних процесів необхідно не тільки вміти записати рівняння реакції, але й дати кількісну оцінку процесу. Кількісна характеристика повинна містити інформацію про напрямок і глибину протікання окисно-відновної реакції. Окисно-відновні процеси підкоряються всім загальним законам хімії. У хімічній термодинаміці кількісною мірою ступеня протікання у певному напрямку будь-якого процесу є константа рівноваги, що обчислюється за загальними правилами. Однак чисельні значення константи рівноваги незручно використовувати в практичному відношенні, тому що для різних окисно-відновних систем вони змінюються в занадто великому інтервалі: від величин, менших, ніж 10–50, до величин, більших за 1020. Тому використовують не величину константи рівноваги, а однозначно пов’язану з нею величину зміни вільної енергії
Гіббса Go: Gок.-відн. = − RT lnKок.-відн.
Це дозволяє оперувати з більш зручними чисельними значеннями величин. Електродні потенціали. При контакті електроду з електролітом
відбувається обмін зарядженими частинками (йони та електрони) між двома фазами. Рівновага на межі поділу електрод–розчин характеризується рівністю електрохімічних потенціалів металу в кристалічній гратці та йонів металу в розчині. Стрибок потенціалів на межі поділу фаз є електродним потенціалом. Тобто, при зануренні металу у водний розчин, що містить йони цього металу, на поверхні поділу метал-розчин утворюються два шари із протилежними зарядами – подвійний електричний шар – і виникає різниця потенціалів між металом і розчином. Величина цієї різниці потенціалів залежить від природи металу, концентрації йонів металу та температури. Однак не існує надійного методу визначення абсолютного значення різниці потенціалів.
Можна обрати два яких-небудь метали (наприклад, Zn і Cu) у вигляді пластинок, занурених у розчини своїх солей, які розділені діафрагмою. Кожний із металів може виділити в розчин ту кількість йонів, яка відповідає рівновазі його з розчином. Однак, рівноважні потенціали цих металів не будуть однаковими. Якщо пластинки сполучені дротом, то
12
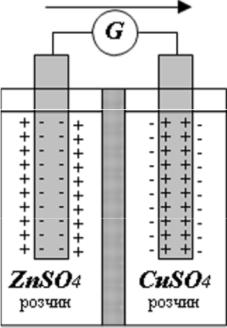
різниця цих потенціалів приводить до переходу частини електронів із цинкової пластинки на мідну. У результаті виникає самодовільний процес, при якому цинкова пластинка розчиняється, а на мідній розряджаються
йони Cu2+ і виділяється металічна мідь. Перехід електронів дротом від цинкової пластинки до мідної дає електричний струм, який можна кількісно охарактеризувати за допомогою електровимірювальних приладів.
Специфічною особливістю більшості окисно-відновних процесів є можливість просторового розділення процесів окиснення (віддачі електронів) і процесів відновлення (приєднання електронів). Ці процеси здійснюються в електрохімічних комірках на поверхнях поділу електродів і розчинів, що знаходяться з ними в контакті. Звичайна рідинна електрохімічна (або гальванічна) комірка схематично показана на рис. 1.
Комірки, у яких протікають роздільно реакції окиснення і відновлення, називають «напівелементами», а система в такому випадку становить собою хімічне джерело струму – гальванічний елемент.
Рисунок 1. Мідно-цинковий гальванічний елемент
Хімічна реакція в гальванічному елементі протікає на електродах у вигляді двох електродних реакцій: окиснення та відновлення. Електрод, на якому відбувається процес окиснення, називається анодом; електрод, на якому здійснюється відновлення – катодом. Електроди можуть бути виготовлені з різних речовин. Найпростіші електроди становлять собою метали, занурені в розчини власних солей. До гальванічних елементів, що містять металічні електроди, відноситься мідно-цинковий елемент (елемент Даніеля-Якобі). Елемент Даніеля-Якобі раніше широко використовувався як джерело постійного струму.
У гальванічному елементі протікає реакція:
13
Zn(тв) + CuSO4(р-н) = ZnSO4(р-н) + Cu(тв).
Роль анода виконує цинковий електрод, на якому відбувається процес окиснення: Znо = Zn2+ + 2ē. На мідному катоді йде процес відновлення
йонів Купруму: Cu2+ + 2ē = Cuо. При сумуванні рівнянь електродних процесів можна одержати рівняння реакції, що протікає в гальванічному елементі:
Znо + Cu2+ = Zn2+ + Cuо.
Гальванічний елемент схематично позначається шляхом перерахування реагентів і продуктів зліва – направо:
анод | анодний розчин || катодний розчин | катод.
Одна вертикальна лінія позначає зміну фази. Подвійна вертикальна лінія вказує наявність проникної перегородки або сольового електролітичного містка між розчинами для виключення можливості їх змішування. Так, схема мідно-цинкового гальванічного елемента записується наступним чином:
Zn | ZnSO4 || CuSO4 | Cu |
або |
Zn | Zn2+ || Cu2+ | Cu. |
Проведення хімічної реакції при просторовому розподілі реакцій окиснення та відновлення з вимірюванням переносу електронів у зовнішньому ланцюгу (у гальванічному елементі) дозволяє кількісно перетворити роботу хімічного процесу в електричну роботу, якщо процес здійснюється оборотно. Це дозволяє безпосередньо дослідним шляхом визначити величину ΔGоок.-відн., вимірявши її в електричних одиницях. Залишається лише виразити Go через електрорушійні сили відповідних гальванічних елементів. Величина Go визначена відповідно до правила знаків термодинаміки: позитивною вважається енергія, що набувається системою. З електричною роботою інша справа: позитивною названа робота системи над навколишнім середовищем (тобто позитивна величина Аел. пов'язана із втратою енергії системи). Це приводить до наступного рівняння,
що пов’язує Gо та Аел.: Gо = − Аел.
Електрична робота визначається через електрорушійну силу (ЕРС) Е та кількість електрики. Якщо в хімічному джерелі струму перетворюється 1 моль деякої речовини, при цьому відбувається робота
Аел. = nFE,
де F – число Фарадея, рівне 9,64846·104 Кл/моль; n – число електронів, що беруть участь в окисно-відновному процесі при перетворенні однієї формульної одиниці речовини. В результаті отримуємо співвідношення між
Gо і експериментально визначеною величиною ЕРС хімічного джерела |
|
струму Е: |
ΔG = –nFE. |
|
|
14
Таким чином, для самодовільної реакції ΔG<0, а Е>0.
На сьогодні ще не розроблені ні експериментальні, ні теоретичні методи надійного визначення потенціалів, що відповідають окремим електродам гальванічного елемента. Можна точно визначати лише ЕРС ланцюгу, тобто різницю потенціалів двох електродів. Однак у більшості випадків для практичних цілей достатньо мати умовні величини, що характеризують потенціали різних електродів стосовно потенціалу якогонебудь електрода, обраного за стандарт. Знаючи ці величини для двох напівелементів, можна визначити ЕРС складеного з них ланцюга.
У якості такого електрода порівняння у водних розчинах найчастіше застосовується нормальний водневий електрод. За умовну величину, що характеризує потенціал деякого електрода, приймають ЕРС гальванічного елемента, складеного із цього електрода та нормального водневого електрода. Цю величину називають електродним потенціалом даного електрода. Обговоримо, що собою представляє нормальний стандартний водневий електрод. Стандартний нормальний водневий електрод є електрохімічною коміркою (напівелемент), у якому відбувається реакція йонізації молекулярного водню, причому активність йонів Гідрогену в
розчині відповідає [H3O+] = 1 моль/л (pН = 0) і парціальний тиск водню в газовій фазі рівний 101,3 кПа (1 атм) при температурі 298 K. Стехіометричне рівняння процесу йонізації водню має такий вигляд:
½Н2(газ) + Н2О(р) = Н3О+(р) + ē (електрод). |
(1) |
Оборотний процес йонізації водню проводять на металічній платині (платиновій губці). Хоча в передачі електронів металічна платина тут відіграє тільки роль посередника, її роль далеко не універсальна, і платину не вдається замінити іншими металами. Властивості платини є найбільш сприятливими для проведення цієї оборотної реакції.
Для виміру електродного потенціалу складається гальванічний елемент, електродами якого є досліджуваний та нормальний водневий. ЕРС гальванічного елемента (окисно-відновної системи) дорівнює алгебраїчній різниці потенціалів нормального водневого електрода та досліджуваного електрода (ϕx):
ЕРС= Е = ϕ = | ϕ°вод.ел. – ϕx |.
Оскільки стандартний електродний потенціал водневого електрода за
визначенням дорівнює нулю ϕ°вод. ел. = 0, то |ϕx| = ЕРС.
Значення електродного потенціалу залежить від ряду факторів: природи речовин, що беруть участь в електродному процесі, їх концентрації, температури, від природи розчинника. Щоб врахувати тільки природу речовин, що беруть участь в окисно-відновному процесі, введене поняття стандартного електродного потенціалу. Стандартним електродним потенціалом називається електродний потенціал електрода при температурі 298 K, тиску 101,3 кПа, при концентраціях (активностях) у водних розчинах
15

усіх речовин, що приймають участь в електродних процесах, рівних одиниці. Стандартний електродний потенціал позначають символом ϕ° (Ео).
Вибір як системи відліку реакції окиснення молекулярного водню (електродний потенціал якої умовно прирівняний нулю, рівняння (1)) означає, що для порівняння властивостей різних окисно-відновних систем використовується здатність відповідних сполук відновлюватися молекулярним воднем у водних розчинах відповідно до рівняння (2), а в якості кількісної характеристики цієї здатності береться значення
стандартного електродного потенціалу (ϕо), визначеного як ЕРС гальванічного елемента, побудованого з⁄ напівелемента, що містить компоненти окисно-відновного процесу ( ) при концентраціях (або активностях) А і , рівних 1 моль/л, і напівелемента – водневого електрода
при [H3O+] = 1 моль/л і p(H2) = 101,3 кПа.
|
А (розчин) + b/2H2 (газ) + bН2O = |
(розчин або тв.) + bН3O+(розчин) |
(2) |
|||
(А може мати будь-який знак, а Ab- містить b додаткових негативних зарядів у порівнянні з А). |
||||||
|
Таким чином, стандартний електродний потенціал (ϕо) системи |
|||||
|
служить кількісною мірою її здатності здійснювати окиснення |
|||||
молекулярного водню до H |
O+ у водному розчині. Величина ϕо |
однозначно |
||||
⁄ |
3 |
|
|
о |
0, то система менш |
|
визначає константу рівноваги реакції типу (2). Якщо ϕ |
|
|||||
активна, ніж молекулярний водень у віддачі електронів і з підвищенням ϕо |
||
> |
о |
0, то |
мова йде про посилення окисних властивостей частинки А. Якщо ϕ |
|
|
протікає процес, зворотний |
реакції (2). Чим більш негативне значення |
||
набуває ϕо, тим сильніше виражені відновні властивості частинки |
. |
< |
|
Електродами можуть |
служити метали, як наприклад |
у |
мідно- |
цинковому гальванічному елементі. Однак електроди можуть бути виготовлені з іншого матеріалу, і на них можуть бути здійснені будь-які електродні реакції, включаючи досить складні, наприклад:
Mn2+ + 4H2O = MnO4– + 8H+ + 5ē.
Електрод характеризується негативним значенням електродного потенціалу, якщо відносно стандартного водневого електрода виступає в ролі відновника. При цьому в гальванічному елементі здійснюється перенос електронів від відповідного електрода до стандартного водневого електроду. І навпаки: електрод характеризується позитивним електродним потенціалом, якщо відносно стандартного водневого електрода виступає в ролі окисника. У зовнішньому ланцюзі відповідного гальванічного елемента електрони переносяться від стандартного водневого електрода до даного електрода.
Для ілюстрації наведеного правила розглянемо цинковий і мідний електроди. На цинковому електроді здійснюється електродний процес:
Zn2+ + 2ē = Znо |
ϕ° = –0,763 В. |
Стандартний електродний потенціал є негативним. Це означає, що в
16
