
2.2 Термодинамика и химизм гидрогенолиза сернистых соединений
В таблице 2.2 приведены значения констант равновесия и теплоты реакций гидрогенолиза S-органических соединений различных групп. Все реакции
|
гидрогенолиза экзотермичны, константы равновесия имеют большие значения. Теплота гидрогенолиза связи С-S слабо меняется с температурой.
Таблица 2.2 - Значения теплот и констант равновесия реакций гидрогенолиза в идеальной газовой фазе | ||||||
|
|
Температура, °С | |||||
|
25 |
225 |
525 | ||||
|
∆H0 |
∆Kp |
∆H0 |
∆Kp |
∆H0 |
∆Kp | |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
СН3SН + Н2 → СН4+ Н2S |
-72,1 |
7,6* 1012 |
-74,4 |
6,3 *107 |
-77,7 |
6,8 *104 |
|
С3Н7SН + Н2 →С3Н8+Н2S |
-17,9 |
2,6 *109 |
-51,4 |
9,5 *105 |
-55,9 |
7,7*103 |
|
С5Н11SН + Н2 →С5Н12+Н2S |
-58,2 |
3,9 *1010 |
-61,1 |
2,8* 106 |
-66,6 |
9,0* 103 |
|
СН3SС3Н7 + 2Н2 → СН4+ С3Н8+ Н2S |
-120,2 |
2,1*1010 |
-126,7 |
6,0 *1013 |
-135,3 |
4,7* 10-8 |
|
СН3SС4Н9+ 2Н2→СН4+ С4Н10+ Н25 |
-108,6 |
1,1*1021 |
-115,1 |
2,0*1013 |
-124,0 |
4,5* 108 |
|
С2Н6S2+ ЗН2 → 2СН4+ 2Н2S (2,3дитиабутан) |
-166,1 |
6,2*1031 |
-174,9 |
9,6 *1019 |
-187,1 |
8,4* 1013 |
|
С4Н10S2 + ЗН2 → 2С2Н6+ 2Н2S (3,4-дитиагексан) |
-135,2 |
7,6*1026 |
-146,4 |
1,4*1017 |
-160,5 |
1,5*1011 |
|
С4Н4S + 4Н2 →С4Н10+ Н2S (тиофен) |
-262,4 |
5,3*1030 |
-273,0 |
1,3*101Э |
-283,6 |
18,5 |
|
С5Н6S + 4Н2→С5Н2+Н2S (3-метил тифен) |
-257,8 |
2,9 *1029 |
-267,9 |
1,6*1011 |
-277,0 |
3,5 |
|
С4Н8S+ 2Н2→С4Н10+Н2S (тиациклопентан) |
-112,6 |
5,4*1016 |
-116,5 |
6,2 108 |
-121,8 |
1,4*104 |
|
С5Н10S + 2Н2→С5Н12+Н2S (тиациклогексан) |
-103,4 |
2,8*1016 |
-197,3 |
1,4*109 |
-117,0 |
6,3*104 |
Из таблицы 2.2 следует, что наибольший тепловой эффект наблюдается для тиофеновых структур. Гидрогенолиз тиофена до бутана и сероводорода ограничивается термодинамическим равновесием:
٭ где ∆Н - теплота реакции гидрогенолиза S-органических соединений различных групп;
∆Кр - константа фазового равновесия.
Селективному гидрообессериванию способствует разность в энергиях связей С-S и С-С. Однако, участие катализатора в процессе снижает энергию активации за счет адсорбции на его поверхности промежуточного активированного комплекса. Перераспределение энергий в комплексе приводит к разрыву связей С-S и С-N, как показано в таблице 2.3.
Таблица 2.3 - Средние значения энергии связей (кДж/моль) до реакции и в переходном комплексе
|
Тип связи |
В свободном состоянии |
В переходном состоянии |
|
С— С |
345,4 |
205 |
|
С—N |
304,4 |
110 |
|
С— S |
271,8 |
21 |
|
С— 0 |
357,6 |
17 |
При гидроочистке бензиновых фракций на алюмокобальтомолибденовом катализаторе энергия активации гидрогенолиза сернистых соединений составляет 16 кДж/моль, а азотистых — 83,7 кДж/моль.[2, с.790]
Таким образом, при гидроочистке происходит преимущественное разрушение гетероорганических соединений в отличие от углеводородов, которые устойчивы.
Все серосодержащие соединения подвергаются гидрогенолизу до сероводорода и соответствующих углеводородов:
- меркаптаны: RSH+H2 → RH+H2S; [2, с.790] (2.1)
- сульфиды: RSR1 + H2 →RH+ R1SH →R1H+ H2S [2, с.790] (2.2)
-дисульфиды: RSSR1+H2 →RSH+R1SH→RH+ R1H+ 3H2S [2, с.790] (2.3)

А глубина гидрогенолиза тиофена при различных температурах и давлении представлена в таблице 2.4.
|
Таблица 2.4 - Равновесная глубина гидрогенолиза тиофена при различных температурах и давлении | ||||
|
Температура, °С |
Глубина гидрогенолиза (%) при давлении, МПа | |||
|
0,1 |
1,0 |
4,0 |
10,0 | |
|
227 |
99,2 |
99,9 |
100,0 |
100,0 |
|
327 |
98,1 |
99,5 |
99,8 |
99,8 |
|
427 |
90,7 |
97,6 |
99,0 |
99,4 |
|
527 |
68,4 |
92,3 |
96,6 |
98,0 |
|
627 |
28,7 |
79,5 |
91,3 |
95,1 |
Увеличить превращение тиофена можно повышением общего давления и молярного соотношения водорода к сырью. При практическом осуществлении гидроочистки нефтяных фракций, содержащих тиофены, достичь полного удаления серы не удается. При высоком содержании сернистых соединений в сырье тепловыделение в реакторе может быть довольно значительным. При этом могут протекать реакции гидрокрекинга углеводородов с образованием продуктов меньшей молекулярной массы:
R── СН2—СН2—R′ + Н2 ↔ R── СН3 + СН3—R′ [2, c.271 ] (2.5)
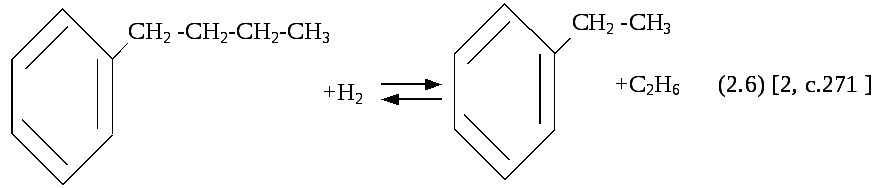
Теплоты гидрирования связей С—S и С—С близки между собой. Это показано в таблице 2.5. Чем в более мягких условиях протекает процесс гидроочистки, тем меньше удельный вес реакций гидрокрекинга углеводородной части сырья.
При гидроочистке кроме сернистых соединений превращению подвергаются соединения азота и кислорода.
|
Таблица 2.5 -Теплота реакций гидрогенолиза некоторых соединений | ||
|
Реакция |
-∆H кДж/моль | |
|
|
527 °С |
627 °С |
|
С6Н13SН + Н2 →н- С6Н14+ Н2S |
66,7 |
68,7 |
|
С8Н17SН + Н2→ н- С8Н18+ Н2S |
66,7 |
68,5 |
|
н-С6Н14 +Н2 → СН4+ С5Н12 |
61,9 |
63,5 |
|
н-С8Н18 + Н2 → СН4+ н-С7Н16 |
61,9 |
63,5 |
Теплота гидрогенолиза (∆H) азотистых и кислородсодержащих соединений выше, чем сернистых [2, с.792].
С6Н13SН + Н2 →С6Н14+ Н2S ∆H= -69 кДж/моль [ 2, c.271 ] (2.7)
С6Н13SН + Н2 → С6Н14+ Н20 ∆H= -93 кДж/моль [ 2, c.271 ] (2.8)
С6Н13SН + Н2 → С6Н14+ NН3 ∆H = -87кДж/моль [ 2, c. 271] (2.9)
В промышленных условиях за счет гидрирования азотистых и кислородных соединений тепловыделение в реакторе может увеличиться на 10-15 %.
Для расчета теплоты гидроочистки (q) предложена формула:
q=∆Hk×∆Zk+∆Hs×(∆Zs), [ 2, c.271 ] (2.10)
где ∆Hk — теплота образования единицы массы низкокипящих (по сравнению с сырьем) углеводородов; ∆Zk — изменение содержания этих углеводородов; ∆Hs — теплота удаления единицы массы серы; ∆Zs — изменение содержания серы.
Для расчета по вышеприведенной формуле необходимо предварительно измерить величины ∆Zk и ∆Zs.
Для расчета теплоты гидроочистки с удалением кроме серы также азота и кислорода уравнение принимает вид:
q = -115×∆Zk+5525×∆Zs+6230×∆Zo+n [2, c.271] (2.11)
Кроме описанных выше реакций при гидроочистке происходит также гидрирование ненасыщенных соединений, содержащихся в сырье, особенно при добавлении к прямогонным фракциям продуктов термического и каталитического крекинга. Экзо эффект может достигать величин 120-180 кДж/кг.
Скорости этих реакций довольно велики по сравнению с гидрообессериванием.
 [2,
c.271]
[2,
c.271]
Реакции гидрирования непредельных соединений и гидрокрекинга углеводородной составляющей сырья влияют на технико-экономические показатели процесса, увеличивая расход водорода.
При гидрообессеривании наиболее реакционно-способными являются меркаптаны, сульфиды, дисульфиды. Устойчивость сернистых соединений при гидроочистке возрастает в следующем ряду:
меркаптаны < дисульфиды < сульфиды < тиофены.
Внутри группы сернистых соединений скорость гидрообессеривания снижается с увеличением молекулярной массы.
Соединения азота и кислорода содержатся в нефтяных фракциях в значительно меньших количествах, чем соединения серы. Они сосредоточены в высококипящих фракциях и особенно тяжелых остатках. Азотсодержащие соединения представлены азотистыми основаниями и нейтральными азотистыми соединениями.
Независимо от природы, они отравляют катализаторы риформинга и гидрокрекинга, снижая их кислотную функцию. Удаление их из нефтяных фракций повышает качество топлив. Присутствие азотистых соединений тормозит процесс обессеривания. Для их удаления требуются более жесткие условия и специальные катализаторы. Превращения азотистых соединений в условиях гидроочистки показаны ниже.

Из уравнений следует, что первоначальной реакцией является гидрирование кольца, содержащего гетероатом, его разрыв с образованием первичных и вторичных аминов и их гидрогенолиз с образованием ароматических углеводородов и аммиака.
Кислородсодержащие соединения при гидрировании образуют углеводороды и воду. Превращения кислородсодержащих соединений в условиях гидроочистки показаны ниже.

