
11-25-12_10-34-35 / Лекции по химии нефти 9 экзамен
.docЛЕКЦИЯ ПО ХИМИИ НЕФТИ № 9
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ, ОЛЕФИНЫ), ОБРАЗУЮЩИЕСЯ ПРИ ПЕРЕРАБОТКЕ НЕФТИ
Непредельные углеводороды – это углеводороды ряда СnH2n, имеющие в структуре молекулы двойную связь. Наличие двойной связи определяет их высокую реакционную способность.
В обычных нефтях и природных газах непредельные углеводороды отсутствуют. Они могут появиться в результате крекинга парафинов или нафтенов. В нефтях, добываемых внутрипластовым горением, за счет неизбежного горения пласта могут образовываться непредельные углеводороды. Олефины являются важнейшим сырьем для нефтехимического синтеза.
Основные процессы, в которых получаются непредельные углеводороды:
пиролиз низкомолекулярных углеводородов;
термический крекинг;
каталитический крекинг;
каталитический риформинг;
коксование нефтяных остатков.
Процесс пиролиза позволяет получать низкомолекулярные олефины: этилен и пропилен, которые при обычных условиях являются газами. В процессе пиролиза олефины являются целевыми продуктами. Из низкомолекулярных алкенов получают полимеры. Алкены С4 и С5 получают в процессе каталитического дегидрирования соответствующих парафиновых углеводородов. Все большую значимость в нефтехимии начинают приобретать более высокомолекулярные -олефины, у них двойная связь в конце молекулы. -олефины являются хорошими растворителями, используются в дальнейшем синтезе, а также при окислении получают одно- и двухосновные карбоновые кислоты, которые в свою очередь являются сырьем для получения СМС.
В процессе термического крекинга под действием высокой температуры из остатков прямой перегонки нефти (мазуты, полугудроны, гудроны) получают более низкомолекулярные парафиновые и олефиновые углеводороды.
Процессы пиролиза и термического крекинга – это некаталитические процессы, протекающие по радикально-цепному механизму. Термодинамическая стабильность углеводородов снижается с повышением температуры. В одном гомологическом ряду стабильность падает с повышением молекулярной массы. Для переработки алканов в алкены достаточно простого нагревания до высокой температуры. Однако олефины с легкостью вступают во вторичные реакции полимеризации и термического разложения. Поэтому, чтобы добиться максимального выхода олефина, необходимо реакцию остановить в момент наибольшей их концентрации.
В процессе каталитического крекинга при температуре 450 – 525 0С и атмосферном давлении в присутствии кислотных алюмосиликатных катализаторов получают высокооктановый бензин из темных нефтяных фракций.
На установках каткрекинга получают жирный газ, нестабильный бензин, легкий и тяжелый каталитический газойль.
Углеводородный газ содержит 80 – 90 % фракции С3 – С4 и используется в дальнейшем в процессах алкилирования, полимеризации, для производства этилена, пропилена, бутадиена, изопрена, полиизобутилена и других нефтехимических продуктов.
Бензиновая фракция (н.к. – 195 0С) применяется как компонент автомобильного и авиационного бензина. В ее состав входит до 30 % масс. ароматики, до 15 % нафтенов и до 50 % парафинов. ОЧ бензиновой фракции составляет 78 – 85 (по моторному методу).
Легкий газойль (175 – 350 0С) используется как компонент дизельного топлива с ЦЧ 35 – 45.
Остаточный продукт каталитического крекинга – тяжелый газойль – используется в качестве сырья для термического крекинга.
Реакции углеводородов при каталитическом крекинге протекают по цепному карбкатионному механизму.
Основным преимуществом каталитического крекинга перед термическим крекингом является более высокая скорость реакции в присутствии катализатора и бóльшая ценность получаемых продуктов.
В процессе каталитического риформинга при температуре 480 – 540 0С, давлении 2 – 4 МПа (20 – 40 атм.) в среде водородсодержащего газа в присутствии алюмоплатиновых катализаторов из прямогонных бензиновых фракций получают высокооктановые бензины или индивидуальные ароматические углеводороды. В процессе риформинга используют бифункциональные катализаторы, сочетающие кислотную и гидрирующую – дегидрирующую функции. Платина активна в реакциях гидрирования и дегидрирования. Она способствует образованию ароматических соединений и гидрированию промежуточных олефинов, предотвращая коксообразование. Содержание платины в катализаторе составляет 0,3 – 0,65 %. Окись алюминия в алюмоплатиновом катализаторе выполняет кислотную функцию, и определяет активность катализатора в реакциях изомеризации и гидрокрекинга.
Реакции углеводородов при каталитическом риформинге протекают по цепному карбкатионному механизму.
Фракционный состав сырья риформинга определяется целевым продуктом процесса. Если целью процесса является получение индивидуальных аренов, то для получения бензола, толуола и ксилолов используют фракции, содержащие углеводороды С6 (62 – 85 0С), С7 (85 – 105 0С) и С8 (105 – 140 0С). Если процесс проводится с целью получения высокооктанового бензина, то в качестве сырья используют фракцию 85 – 180 0С, соответствующую углеводородам С7 – С9.
Основными продуктами риформинга являются водородсодержащий газ и риформат, используемый как высокооктановый компонент автомобильных бензинов (ОЧ 85 по моторному методу или 95 по исследовательскому методу) или направляют на выделение индивидуальных аренов. Бензины катриформинга содержат до 60 % масс. ароматики, до 30 % парафинов, до 15 % нафтенов и около 2 % непредельных соединений. Бензин катриформинга из-за высокого содержания ароматики, приводящей к повышенному нагарообразованию, не может в чистом виде использоваться в качестве топлива для автомобилей.
Автомобильные бензины представляют собой смесь прямогонных бензинов, бензинов катриформинга и каткрекинга с добавлением высокооктановых компонентов и различных присадок.
Присутствие непредельных углеводородов в моторных топливах и смазочных маслах крайне нежелательно, т.к. в процессе хранения они полимеризуются и осмоляются, ухудшая качество нефтепродукта и сокращая сроки его хранения. Содержание непредельных углеводородов в авиационных бензинах, в реактивных и дизельных топливах лимитируется в ГОСТах йодным числом (количество грамм йода, присоединяющегося к непредельным углеводородам, содержащимся в 100 г нефтепродукта). Массовая доля непредельных углеводородов определяется по йодному числу и средней молекулярной массе испытуемого нефтепродукта. Для авиационных бензинов и реактивных топлив йодное число не более 2, для дизельных топлив не более 6 гJ2/100 г нефтепродукта.
ХИМИЧЕСКИЕ СВОЙСТВА НЕПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
Из-за наличия в молекуле непредельного углеводорода двойной связи, олефины характеризуются высокой химической активностью. Основные реакции олефинов:
реакции гидрирования;
реакции гидратации;
реакции окисления;
реакции полимеризации;
реакции алкилирования;
реакции с серной кислотой;
реакции галогенирования;
оксисинтез и др.
Реакции гидрирования. Водород к алкенам присоединяется при комнатной температуре в присутствии тонкоизмельченной платины или палладия:
RCH=CH2 + H2 RCH2CH3
Реакции гидратации в присутствии кислых катализаторов приводит к образованию спиртов. Существует два метода гидратации:
1) При сернокислотной гидратации на первом этапе образуются алкилсерные кислоты. На втором этапе при разбавлении алкилсерных кислот водой в результате гидролиза образуются спирты.
+ H2O
R

 CH=CH2
+ H2SO4
RCHCH3
RCHCH3
+ H2SO4
CH=CH2
+ H2SO4
RCHCH3
RCHCH3
+ H2SO4
OSO3H OH
алкилсерная кислота спирт
От концентрации H2SO4 будет зависеть качество и выход целевых продуктов, а также возможность протекания побочных реакций. Концентрация H2SO4 может варьироваться от 50 % до 80 %.
У низкомолекулярных олефинов реакционная способность в данной реакции возрастает в ряду С2 С3 н-С4 изо-С4.
При протекании сернокислотной гидратации с увеличением температуры увеличивается и скорость процесса, при этом также и увеличивается роль полимеризации, т.е. протекание побочных реакций.
2) Прямая гидратация проводится при 300 0С в присутствии жидких или твердых катализаторов. С увеличением молекулярной массы олефина их склонность к прямой гидратации резко увеличивается, поэтому для олефинов С4+ВЫШЕ этот метод практически не используется. В качестве жидких катализаторов могут быть использованы серная и фосфорная кислоты, а также могут быть кислоты на твердых носителях, или Al2O3.
R CH=CH2
+ H2O
RCHCH3
CH=CH2
+ H2O
RCHCH3
OH
Реакции окисления. Наиболее важной реакцией окисления олефинов является получение окиси этилена и пропилена при температуре 280 0С в присутствии серебряного катализатора.
С

 Н2=СН2
+ О2
СН2
СН2
Н2=СН2
+ О2
СН2
СН2
О
С
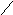 Н3СН=СН2
+ О2
СН3СН
СН2
Н3СН=СН2
+ О2
СН3СН
СН2

О
Оксид этилена и пропилена является сырьем, без которого невозможно обойтись в производстве неиногенных ПАВ, используемых в качестве химических реагентов для увеличения нефтеотдачи пластов, и в процессе обезвоживания и обессоливания в системе сбора, транспортировки и подготовки нефти.
Реакции полимеризации широко применяются в нефтехимическом синтезе для получения полиэтилена низкого давления ПЭНД и полиэтилена высокого давления ПЭВД. Они различаются числом полимерных звеньев. При полимеризации бутиленов, изопренов получают синтетические каучуки.
В нефтеперерабатывающей промышленности в процессе ди-, три- и тетрализации низкомолекулярных олефинов С2 – С4 получают компонент моторного топлива или полимербензин.
Реакции алкилирования нами рассматривались в предыдущих лекциях. Алкилирование изобутана бутиленом с целью получения высокооктанового компонента моторных топлив. Алкилирование с ароматическими углеводородами для получения алкилароматики.
Реакции галогенирования является важной реакцией для получения растворителей дихлорэтана и хлористого винила. Эта реакция может протекать в газовой и жидкой фазах.
t, 0C
CH2=CH2 + Cl2 CH2ClCH2Cl CH2=CHCl + HCl
дихлорэтан хлорвинил
Хлористый винил можно получать из ацетилена:
СHCH + HCl CH2=CHCl
Оксосинтез – реакция взаимодействия алкенов с окисью углерода и водородом в присутствии кобальтового катализатора используется для производства альдегидов. Дальнейшее восстановление альдегидов позволяет получать соответствующие первичные спирты.
О

С Н2=СН2
+ СО + Н2
СН3СН2С
Н2=СН2
+ СО + Н2
СН3СН2С
Н
