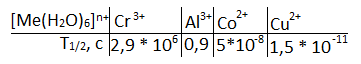- •Зависимость термодинамической реакционной способности веществ от температуры.
- •Реакционная способность металла в водных средах.
- •Оценка реакционной способности с помощью диаграммы Пурбе (е, рН).
- •Реакционная способность комплексных (координационных) соединений.
- •ΣГидрадные комплексы.
- •Карбонильные комплексы.
- •Комплексы с нулевым зарядом.
- •Типы связей в комплексных соединениях.
- •Строение комплексов.
- •Устойчивость комплексов.
- •Типы реакций между комплексными соединениями.
- •Гетероциклы
- •Краун-эфиры.
- •Применение краун-эфиров.
- •Криптанды.
- •1) Понятия реакционной способности.
Строение комплексов.
Одним из признаков является устойчивые геометрические фигуры: многогранники или полиэдра. В зависимости от координационного числа возможны различия полиэдров. Координационные числа 2, 4, 6 наиболее устойчивы.
[Al(NH3)2]OH
[NH3–Ag–NH3]+
Если координационное число равно 4, то геометрической фигурой будет являться тетраэдр или квадрат; квадраты очень распространены.

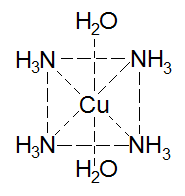

В тетраэдрической форме встречаются значительно реже.
[Fe(CN6)]3-
Характерны виды изомерии:
Геометрическая изомерия
У координационного числа 6 может быть больше шести изомеров.

Связевая изомерия
Возможна тогда, когда у лиганд может быть несколько неподелённых электронных пар.
![]()
Лигандная изомерия.
Имеет одинаковый электронный состав, но различный лигандный состав.
а) [Cr(H2O)6]Cl3
б) [Cr(H2O)5Cl]Cl2 * H2O
в) [Cr(H2O)4Cl2]Cl * 2H2O
Если добавить к первому AgNO3, то в осадок выпадет 3AgCl, если во второй – 2AgCl, если в третий – AgCl.
Устойчивость комплексов.
В растворе комплексные соединения в некоторой степени диссоциируют на составные части.
Состояние равновесия характеризует константа равновесия (Кр, Куст, Кобр)
Cu2+ + NH3 = [Cu(NH3)]2+
Для каждой ступени комплексов своя константа.
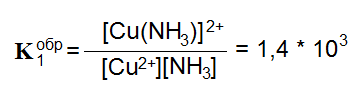
[Cu(NH3)]2+ + NH3 = [Cu(NH3)2], K2обр=3,1 * 103
[Cu(NH3)3] + NH3 = [Cu(NH3)4]- , K3обр=7,7 * 103
Cu2+ + 4NH3 = [Cu(NH3)4]2+
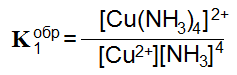
Общая Kобр есть произведение всех Kобр данных ступеней.
Kобр = K1 * K2 * K3 * K4 = 4,7 * 10-12
По мере возрастания числа лигандов, уменьшается Kобр. Величина, обратная Kобр – константа нестойкости Kнест
Kнест = 1/ Kобр
Kобр = e-∆G/RT
Становится реален расчёт энергии связи.
lnKобр = e-∆G/RT
∆G = - RT *lnKобр
∆G = - 8,31 * 298 * ln(4,7 * 1012) = 72 000 Дж = 72 кДж
E(Cu2+-NH3) = 72/4 = 18 кДж.
Зная Kобр можно нерастворимые вещества переводить в растворы.
AgCl – нерастворимый в воде, белый, растворимый в аммиаке.
ПР = 1,6 * 10-10 = [Ag+] * [Cl-]
AgCl = Ag+ + Cl-
р-р
Ag+
=
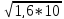 -10
= 1,3 * 10-5
-10
= 1,3 * 10-5
Ag+ + 2NH3 = [Ag(NH3)2]+; Kобр = 1,5 *10-7
При этом осадок распадается. Если добавить I, то снова выпадет осадок.
Ag+
+ I-
= AgI
ПР
= 1,5 * 10-16,
Ag+
=
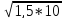 -16
= 1,2 *10-8
-16
= 1,2 *10-8
Ag+ + 2S2O32- = [Ag(S2O3)2]3-
Kобр = 1 * 10-13
Типы реакций между комплексными соединениями.
ОВР
Ионная (обменная)
Окисление Co2+ пероксидом водорода H2O2.
При окислении Co2+ в воде образуется аквакомплекс
[Co(H2O)6]2+
+ H2O2



E(Co3+/Co2+) = 1,92 B, E(H2O2/ H2O) = 1 B.
2[Co(NH3)6]2+ + H2O2 = 2[Co(NH3)6]3+ + OH-

Процесс окисления протекает легко.
Kобр [Co(NH3)6]3+ = 1 * 1036 значительно выше, чем Kобр [Co(NH3)6]2+ = 1 * 10 4. Потенциал понижается, окисление становится возможным.
Обмен лигандами, замещение.
Скорость замещения лигандов для различных соединений очень сильно отличается.
Те реакции, в которых замещение происходит быстро, называют лабильными комплексами.
А если реакция медленная, то она называется инертная реакция.
Числовая характеристика реакции – период полуобмена. T1/2, c
[Me(H2O)6]n+ + H2O. = [Me(H2O)6]n+ * H2O.] + H2O+ [Me(H2O)5 * Н2О.]